Loading AI tools
De Wikipedia, la enciclopedia libre
El sistema del complemento es uno de los componentes fundamentales de la conocida respuesta inmunitaria defensiva ante un agente hostil (por ejemplo, microorganismos)[1]. Consta de un conjunto de moléculas plasmáticas implicadas en distintas cascadas bioquímicas, cuyas funciones son potenciar la respuesta inflamatoria, facilitar la fagocitosis, paralizar patógenos y dirigir la lisis de células incluyendo la apoptosis.[2] Constituyen un 15 % de la fracción de inmunoglobulina del suero.
Fue descubierto hace más de un siglo, al comprobarse la capacidad bactericida del suero fresco, acción mediada por dos factores: uno termoestable (los anticuerpos específicos frente a microorganismos) y otro termolábil, al que se denominó complemento. Los componentes propiamente dichos se nombran con la letra C y un número: C1, C2, C3, C4, C5, C6, C7, C8 y C9.[3]
Está formado por unas aproximadamente 30 glucoproteínas y fragmentos que se encuentran en el suero y otros líquidos orgánicos de forma inactiva, y que al activarse de forma secuencial, producen una serie de reacciones con la finalidad de destruir la célula diana. El sistema se activa por tres vías diferentes.[4]
Denominada así porque se descubrió primero. Su activación es iniciada por inmunocomplejos formados por IgG (inmunoglobulina G) e IgM (inmunoglobulina M). Esta vía se inicia con la unión de dos (en el caso de la participación de IgG) o más (en el caso de IgM) moléculas de inmunoglobulinas unidas a los antígenos respectivos al producirse cambios alostéricos en el extremo Fc.
Los fragmentos Fc de los anticuerpos así unidos a sus antígenos se unen a los brazos radiantes de la molécula C1q que reclutará a C1r y C1s. La unión a C1q de más de una porción Fc de la Ig es requerida para estabilizar el conjunto C1qrs. Este complejo poli-Fc:C1qrs a su vez causa proteólisis (por C1s) de C4 en C4a y C4b y C2 en C2a y C2b. En este punto C4b y C2b formarán un complejo que se situará en la superficie de la célula diana, la C3 convertasa, como se detalla posteriormente. C1 continuaría con su actividad enzimática degradando muchas moléculas de C4 hasta que fuese inactivado por su inhibidor.
Las moléculas C1q no están asociadas al proceso de opsonización, dado que su función es ser la enzima que inicia la cascada clásica del complemento. La C1q también puede activarse gracias a la proteína C reactiva (proteína de fase aguda de unión a fosfocolina células moribundas y a patógenos).
C3a, C4a y C5a tienen funciones de anafilotoxinas, favorecen la desgranulación de células cebadas, liberando así Histamina, sustancia que favorece la inflamación. C4b se une de manera covalente a la membrana de la célula invasora o a un complejo inmune y a C2b en presencia de Mg++, formando la C3 convertasa de la vía clásica, llamada C4bC2b. La C3 convertasa tiene potente acción proteolítica sobre el factor C3, fragmentándola en C3a y C3b (C3a es también anafilotoxina). La unión de C3b sobre la membrana en cuestión es un crítico elemento para el proceso de la opsonización por fagocitos.
(En muchos libros antiguos pone que el fragmento que se fija con el C4b es C2a. Esto hay que desecharlo, la OMS puso que el fragmento que se une a C4b es el C2b y por lo tanto la convertasa está formada por C4bC2b).
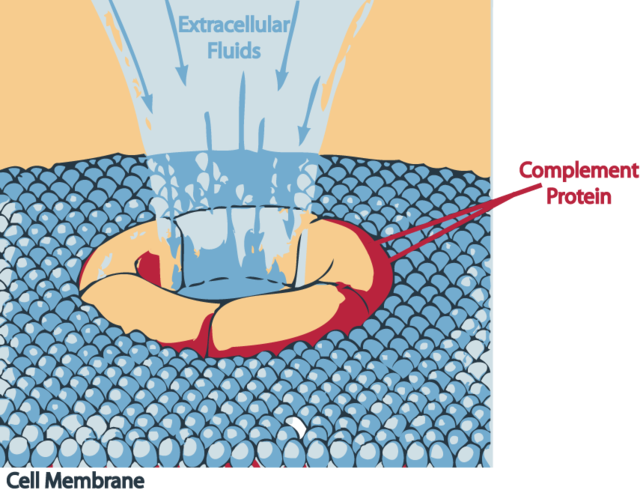
C3b se une al complejo C4bC2b, formando la convertasa C5 de la vía clásica conformada por C4bC2bC3b. Esta causará escisión de C5 en componentes a y b. Igual que con los anteriores, C5a es una anafilotoxina que desgranula a los mastocitos y libera sus mediadores intracelulares y es también un factor quimiotáctico. El componente C5b se unirá a la membrana estabilizado por C6, en particular debido a la naturaleza hidrofóbica de C5b. C7 se inserta en la doble capa lipídica de la membrana unido al complejo C5bC6b estabilizando aún más la secuencia lítica en contra del invasor. Se fijarán los demás factores C8 y Poli-C9 (este último contribuyendo de 12 a 15 unidades). Cuando los componentes se han unido se forma un poro cilíndrico en la célula que permite el paso de iones y agua, causando lisis celular por razón del desbalance osmótico. Este conjunto de proteínas que forman el poro se conocen como MAC: Membrane Attack Complex (Complejo de ataque a la membrana).

Filogenéticamente más primitiva, su activación es iniciada por inmunoglobulinas, por polisacáridos y estructuras poliméricas similares (lipopolisacáridos bacterianos, por ejemplo los producidos por bacilos gram negativos). Esta vía constituye un estado de activación permanente del componente C3 que genera C3b. En ausencia de microorganismos o antígenos extraños, la cantidad de C3b producida es inactivada por el Factor H. Cuando C3 se une a una superficie invasora (evade la acción del Factor H), forma un complejo con el Factor B, el cual se fragmenta por acción del factor D en presencia de Mg++. El complejo C3bBb es altamente inestable y la vía alterna no continúa sin el rol estabilizador de una proteína circulante llamada properdina o P. Se forma de ese modo la C3 convertasa de la vía alternativa (compuesta por C3bBbP), la cual actúa enzimáticamente sobre moléculas adicionales de C3, iniciando el ciclo de amplificación. Incluso algo de este C3b se puede unir a la C3 convertasa y formar la C5 convertasa de la vía alterna (C3bBbPC3b) que hidrolizará C5 en C5a y C5b, convergiendo en los mismos pasos finales de la vía clásica.
Es una especie de variante de la ruta clásica, sin embargo se activa sin la necesidad de la presencia de anticuerpos. Se lleva a cabo la activación por medio de una MBL (mannose binding lectin / lectina de unión a manosa) o también llamada MBP (mannan-binding protein / proteína de unión a manosa), que detecta residuos de este azúcar en la superficie bacteriana, y activa al complejo C1qrs. De otra manera, una segunda esterasa, la esterasa asociada a MBP (denominada MASP, de las siglas de MBL associated serine proteases / MBL asociado a serín proteasas, y de las cuales existen diferentes tipos: MASP-1, MASP-2, MASP-3 y MAP, siendo MASP-2 la más común) actúa sobre C4. El resto de la vía es similar a la clásica.
Estas vías producen una enzima con la misma especificidad: C3; y a partir de la activación de este componente siguen una secuencia terminal de activación común. El propósito de este sistema de complemento a través de sus tres vías es la destrucción de microorganismos, neutralización de ciertos virus y promover la respuesta inflamatoria, que facilite el acceso de células del sistema inmunitario al sitio de la infección.
A. Lisis de células
El MAC (membrane attack complex/complejo de ataque a la membrana) puede lisar bacterias gram-negativas, parásitos, virus encapsulados, eritrocitos y células nucleadas. Las bacterias gram-positivas son bastante resistentes a la acción del complemento.
B. Respuesta inflamatoria
Los pequeños fragmentos que resultan de la fragmentación de componentes del complemento, C3a, C4a y C5a, son llamados anafilotoxinas. Estas se unen a receptores en células cebadas o mastocitos y basófilos. La interacción induce su desgranulación, liberando histamina y otras sustancias farmacológicamente activas. Estas sustancias aumentan la permeabilidad y vasodilatacion. Asimismo, C3a, C5a y C5b67 inducen monocitos, macrófagos y neutrófilos a adherirse al endotelio para iniciar su extravasación.
C. Opsonización
C3b es la opsonina principal del complemento. Los antígenos recubiertos con C3b se unen a receptores específicos en células fagocíticas, y así la fagocitosis es facilitada.
D. La neutralización de virus
C3b induce la agregación de partículas virales formando una capa gruesa que bloquea la fijación de los virus a la célula hospedera. Este agregado puede ser fagocitado mediante la interacción de receptores del complemento y C3b en células fagocíticas.
E. Eliminación de complejos inmunes
Los complejos inmunes (complejos antígeno-anticuerpo circulantes) pueden ser eliminados de la circulación si el complejo se une a C3b. Los eritrocitos tienen receptores para el complemento del tipo 1 que interactúan con los complejos inmunes cubiertos por C3b y los lleva al hígado y al bazo para su destrucción.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.