Destilación
proceso de separar las distintas sustancias que componen una mezcla líquida mediante vaporización y condensación selectivas De Wikipedia, la enciclopedia libre
La destilación es el proceso de separar los componentes o sustancias de una mezcla líquida mediante el uso de la ebullición selectiva y la condensación. La destilación puede resultar en una separación esencialmente completa (componentes casi puros), o puede ser una separación parcial que aumenta la concentración de los componentes seleccionados en la mezcla. En cualquier caso, el proceso explota las diferencias en la volatilidad de los componentes de la mezcla. En química industrial, la destilación es una operación unitaria de importancia prácticamente universal, pero es un proceso de separación física; no una reacción química.

| Destilación | |
|---|---|
| Ramas | |
| Ley de Raoult / Ley de Dalton / Reflujo / Ecuación de Fenske / Método de McCabe-Thiele / Plato teórico / Presión parcial / Equilibrio vapor-líquido | |
| Procesos industriales | |
| |
| Métodos de laboratorio | |
| Técnicas | |
La destilación tiene muchas aplicaciones. Por ejemplo:
- La destilación de productos fermentados produce bebidas destiladas con un alto contenido de alcohol o separa otros productos de fermentación de valor comercial.
- La destilación es un método eficaz y tradicional de desalinización.
- En la industria de los combustibles fósiles, la estabilización del petróleo es una forma de destilación parcial que reduce la presión de vapor del petróleo crudo, lo que lo hace seguro para el almacenamiento y el transporte, además de reducir las emisiones a la atmósfera de hidrocarburos volátiles. En las operaciones intermedias en las refinerías de petróleo, la destilación es una clase importante de operaciones para transformar petróleo crudo en combustibles y materias primas químicas.
- La destilación criogénica conduce a la separación del aire en sus componentes, especialmente oxígeno, nitrógeno y argón, para uso industrial.
- En el campo de la química industrial, se destilan grandes cantidades de productos líquidos crudos de síntesis química para separarlos, ya sea de otros productos, de impurezas o de materiales de partida sin reaccionar.
Una instalación utilizada para la destilación, especialmente de bebidas destiladas, es conocida como destilería. El equipo de destilación en una destilería es un alambique.
Historia
Resumir
Contexto

En 1975, Paolo Rovesti (1902-1983), un químico y farmacéutico conocido como el "padre de la fitocosmética", descubrió un aparato de destilación de terracota en el valle del Indo, en el oeste de Pakistán, que data de alrededor del 3000 a. C.[5] Se encontraron pruebas tempranas de destilación en tabletas acadias con fecha del año 1200 aC que describen operaciones de perfumería. Las tabletas proporcionaron evidencia textual de que los babilonios de la antigua Mesopotamia conocían una forma primitiva de destilación.[6] También se encontraron evidencias tempranas de destilación relacionadas con alquimistas que trabajaban en Alejandría en el Egipto romano en el siglo I.[7] El agua destilada ha estado en uso desde al menos 200 d. C., cuando Alejandro de Afrodisias describió el proceso.[8][9] Los trabajos para destilar otros líquidos continuaron en el antiguo Egipto bizantino bajo Zosimus de Panopolis en el siglo III. La destilación se practicó en el antiguo subcontinente indio , que es evidente en las retortas de arcilla cocida y en los receptores encontrados en Taxila y Charsadda en el moderno Pakistán, que se remonta a los primeros siglos de la Era Común. Estos "alambiques de [Gandhara]" solo podían producir licor muy débil, ya que no había medios eficientes para recolectar los vapores a fuego lento.[10] La destilación en China puede haber comenzado durante la dinastía Han del Este (siglos II-II), pero la destilación de bebidas comenzó en las dinastías Jin (siglos XII-XIII) y Song del Sur (siglos XII-XIII), según evidencia arqueológica.[11]
Una clara evidencia de la destilación del alcohol proviene del químico árabe Al-Kindi en el Irak del siglo IX.[12][13][14] El proceso se extendió posteriormente a Italia,[12][10] donde fue descrito por la Escuela de Salerno en el siglo XII.[7][15] La destilación fraccionada fue desarrollada por Tadeo Alderotti en el siglo XIII.[16] Se encontró un alambique en un sitio arqueológico en Qinglong, provincia de Hebei, en China, que data del siglo XII. Las bebidas destiladas eran comunes durante la dinastía Yuan (siglos XIII-XIV).[11]
En 1500, el alquimista alemán Hieronymus Braunschweig publicó Liber de arte destillandi (El libro del arte de la destilación),[17] el primer libro dedicado exclusivamente al tema de la destilación, seguido en 1512 por una versión muy ampliada. En 1651, John French publicó The Art of Distillation[18] el primer compendio importante en inglés sobre la práctica, pero se ha afirmado[19] que gran parte de él se deriva de la obra de Braunschweig. Esto incluye diagramas con personas que muestran la escala industrial en lugar de la escala de la operación.


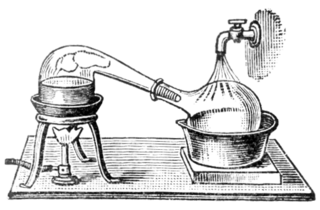


A medida que la alquimia evolucionó hacia la ciencia de la química, los vasos llamados retortas se utilizaron para las destilaciones. Tanto los alambiques como las retortas son formas de cristalería con cuellos largos que apuntan hacia el lado en un ángulo hacia abajo para actuar como condensadores enfriados por aire para condensar el destilado y dejar que gotee hacia abajo para su recolección. Posteriormente, se inventaron los alambiques de cobre. Las juntas remachadas a menudo se mantenían apretadas utilizando varias mezclas, por ejemplo, una masa hecha de harina de centeno.[20] Estas alambiques a menudo presentaban un sistema de enfriamiento alrededor del pico, utilizando agua fría, por ejemplo, que hacía que la condensación de alcohol fuera más eficiente. Estos fueron llamados hervidores. Hoy en día, las réplicas y los alambiques han sido suplantados en gran medida por métodos de destilación más eficientes en la mayoría de los procesos industriales. Sin embargo, el hervidor todavía se usa ampliamente para la elaboración de algunos alcoholes finos, como el coñac, el whisky escocés, el whisky irlandés, el tequila y algunos vodkas. Los contrabandistas de varios materiales (madera, arcilla, acero inoxidable) también son utilizados por contrabandistas en varios países. También se venden alambiques pequeños para su uso en la producción doméstica[21] de agua de flor o aceites esenciales.
Las primeras formas de destilación involucraban procesos por lotes que usaban una vaporización y una condensación. La pureza se mejoró mediante una mayor destilación del condensado. Los mayores volúmenes fueron procesados simplemente repitiendo la destilación. Según los informes, los químicos realizaron entre 500 y 600 destilaciones para obtener un compuesto puro.[22]
A principios del siglo XIX, se desarrollaron los conceptos básicos de las técnicas modernas, incluidos el precalentamiento y el reflujo.[22] En 1822, Anthony Perrier desarrolló uno de los primeros alambiques continuos, y luego, en 1826, Robert Stein mejoró ese diseño para hacer su columna de destilación. En 1830, Aeneas Coffey obtuvo una patente para mejorar aún más el diseño.[23] El alambique continuo de Coffey puede considerarse como el arquetipo de las unidades petroquímicas modernas. El ingeniero francés Armand Savalle desarrolló su regulador de vapor alrededor de 1846.[24] En 1877, a Ernest Solvay se le otorgó una patente de EE. UU. para una columna de bandeja para la destilación de amoníaco y en el mismo año y en los años subsiguientes se produjeron avances en este tema para aceites y bebidas espirituosas.
Con el surgimiento de la ingeniería química como disciplina a fines del siglo XIX, se pudieron aplicar métodos científicos más que empíricos. El desarrollo de la industria petrolera a principios del siglo XX proporcionó el impulso para el desarrollo de métodos de diseño precisos, como el método McCabe-Thiele de Ernest Thiele y la ecuación de Fenske. La disponibilidad de computadoras potentes también permitió simulaciones directas de columnas de destilación.
Aplicaciones de la destilación
Resumir
Contexto
La aplicación de la destilación se puede dividir aproximadamente en cuatro grupos:
- Escala de laboratorio
- Destilación industrial
- Destilación de hierbas para perfumería y medicamentos (destilado de hierbas)
- Procesamiento de alimentos
Los dos últimos son distintivamente diferentes de los dos anteriores en que la destilación no se usa como un verdadero método de purificación, sino más bien para transferir todos los volátiles de los materiales de origen al destilado en el procesamiento de bebidas y hierbas.
La principal diferencia entre la destilación a escala de laboratorio y la destilación industrial es que la destilación a escala de laboratorio a menudo se realiza en forma discontinua, mientras que la destilación industrial a menudo ocurre de manera continua. En la destilación discontinua, la composición del material de origen, los vapores de los compuestos de destilación y el destilado cambian durante la destilación. En la destilación por lotes, un alambique se carga (se suministra) con un lote de mezcla de alimento, que luego se separa en sus fracciones componentes, que se recolectan secuencialmente de la más volátil a la menos volátil, con los fondos, la fracción mínima o no volátil restante. eliminado al final. El alambique puede ser recargado y el proceso repetido.
En la destilación continua, los materiales de origen, los vapores y el destilado se mantienen en una composición constante, rellenando cuidadosamente el material de origen y eliminando las fracciones tanto del vapor como del líquido en el sistema. Esto resulta en un control más detallado del proceso de separación.
Modelo de destilación idealizado
Resumir
Contexto
El punto de ebullición de un líquido es la temperatura a la cual la presión de vapor del líquido es igual a la presión alrededor del líquido, permitiendo que se formen burbujas sin ser aplastadas. Un caso especial es el punto de ebullición normal, donde la presión de vapor del líquido es igual a la presión atmosférica ambiental.
Es un error común pensar que en una mezcla líquida a una presión dada, cada componente hierve en el punto de ebullición correspondiente a la presión dada, permitiendo que los vapores de cada componente se acumulen por separado y de manera pura. Sin embargo, esto no ocurre, incluso en un sistema idealizado. Los modelos idealizados de destilación están esencialmente regidos por la ley de Raoult y ley de Dalton y suponen que se alcanzan los equilibrios vapor-líquido.
La ley de Raoult establece que la presión de vapor de una solución depende de
- la presión de vapor de cada componente químico en la solución y
- la fracción de solución que cada componente constituye, también conocida como la fracción molar.
Esta ley se aplica a las soluciones ideales, o soluciones que tienen componentes diferentes pero cuyas interacciones moleculares son iguales o muy similares a las soluciones puras.
La ley de Dalton establece que la presión total es la suma de las presiones parciales de cada componente individual en la mezcla. Cuando se calienta un líquido de varios componentes, la presión de vapor de cada componente aumentará, lo que hará que aumente la presión de vapor total. Cuando la presión de vapor total alcanza la presión que rodea al líquido, se produce una ebullición y el líquido se convierte en gas en todo el volumen del líquido. Tenga en cuenta que una mezcla con una composición dada tiene un punto de ebullición a una presión dada cuando los componentes son mutuamente solubles. Una mezcla de composición constante no tiene múltiples puntos de ebullición.
Una implicación de un punto de ebullición es que los componentes más livianos nunca "hierven primero" de manera limpia. En el punto de ebullición, todos los componentes volátiles hierven, pero para un componente, su porcentaje en el vapor es el mismo que su porcentaje de la presión de vapor total. Los componentes más ligeros tienen una presión parcial más alta y, por lo tanto, se concentran en el vapor, pero los componentes volátiles más pesados también tienen una presión parcial (más pequeña) y también necesariamente vaporizan, aunque a una concentración más baja en el vapor. De hecho, la destilación por lotes y la fraccionada tienen éxito variando la composición de la mezcla. En la destilación por lotes, el lote se vaporiza, lo que cambia su composición; en el fraccionamiento, el líquido más alto en la columna de fraccionamiento contiene más luces y hierve a temperaturas más bajas. Por lo tanto, a partir de una mezcla dada, parece tener un rango de ebullición en lugar de un punto de ebullición, aunque esto se debe a que su composición cambia: cada mezcla intermedia tiene su propio punto de ebullición, singular.
El modelo idealizado es preciso en el caso de líquidos químicamente similares, como el benceno y el tolueno. En otros casos, se observan desviaciones graves de la ley de Raoult y la ley de Dalton, sobre todo en la mezcla de etanol y agua. Estos compuestos, cuando se calientan juntos, forman un azeótropo, que es cuando la fase de vapor y la fase líquida contienen la misma composición. Aunque existen métodos computacionales que pueden usarse para estimar el comportamiento de una mezcla de componentes arbitrarios, la única forma de obtener datos precisos del equilibrio líquido-vapor es mediante la medición.
No es posible purificar completamente una mezcla de componentes por destilación, ya que esto requeriría que cada componente de la mezcla tenga una presión parcial de cero. Si el objetivo son los productos ultra puros, se debe aplicar una separación química adicional. Cuando una mezcla binaria se vaporiza y el otro componente, por ejemplo, una sal, tiene una presión parcial de cero para propósitos prácticos, el proceso es más simple.
Destilación por lotes o diferencial

Calentar una mezcla ideal de dos sustancias volátiles, A y B, con A la volatilidad más alta, o un punto de ebullición más bajo, en una configuración de destilación por lotes (como en un aparato representado en la figura de apertura) hasta que la mezcla hierve, lo que resulta en un vapor sobre el líquido que contiene una mezcla de A y B. La relación entre A y B en el vapor será diferente de la relación en el líquido. La relación en el líquido se determinará por la forma en que se preparó la mezcla original, mientras que la relación en el vapor se enriquecerá en el compuesto más volátil, A (debido a la Ley de Raoult). El vapor atraviesa el condensador y se elimina del sistema. Esto, a su vez, significa que la proporción de compuestos en el líquido restante ahora es diferente de la proporción inicial (es decir, más enriquecida en B que en el líquido de partida).
El resultado es que la relación en la mezcla líquida está cambiando y se está haciendo más rica en el componente B. Esto hace que el punto de ebullición de la mezcla aumente, lo que resulta en un aumento de la temperatura en el vapor, lo que resulta en una relación cambiante de A : B en la fase gaseosa (a medida que la destilación continúa, hay una proporción creciente de B en la fase gaseosa). Esto resulta en una relación de A : B que cambia lentamente en el destilado.
Si la diferencia en la presión de vapor entre los dos componentes A y B es grande, generalmente expresada como la diferencia en los puntos de ebullición, la mezcla al comienzo de la destilación está altamente enriquecida en el componente A, y cuando el componente A se destila, la ebullición del líquido está enriquecido en el componente B.
Destilación continua
La destilación continua es una destilación en la que una mezcla líquida se alimenta continuamente (sin interrupción) en el proceso y las fracciones separadas se eliminan continuamente a medida que ocurren corrientes de salida a lo largo del tiempo durante la operación. La destilación continua produce un mínimo de dos fracciones de salida, incluida al menos una fracción de destilado volátil, que ha sido hervida y capturada por separado como vapor y luego condensada en un líquido. Siempre hay una fracción de fondo (o residuo), que es el residuo menos volátil que no se ha capturado por separado como vapor condensado.
La destilación continua difiere de la destilación discontinua en el sentido de que las concentraciones no deben cambiar con el tiempo. La destilación continua se puede ejecutar en un estado estable durante un período de tiempo arbitrario. Para cualquier fuente de composición específica, las principales variables que afectan la pureza de los productos en la destilación continua son la relación de reflujo y el número de etapas de equilibrio teóricas, determinadas en la práctica por el número de placas o la altura del relleno. El reflujo es un flujo del condensador que regresa a la columna, generando un reciclaje que permite una mejor separación con un número dado de placas. Las etapas de equilibrio son pasos ideales donde las composiciones logran el equilibrio vapor-líquido, repitiendo el proceso de separación y permitiendo una mejor separación dada una relación de reflujo. Una columna con una alta relación de reflujo puede tener menos etapas, pero refluye una gran cantidad de líquido, lo que proporciona una columna amplia con un gran diámetro. A la inversa, una columna con un índice de reflujo bajo debe tener un gran número de etapas, lo que requiere una columna más alta.
Mejoras generales
Las destilaciones tanto por lotes como continuas se pueden mejorar haciendo uso de una columna de fraccionamiento en la parte superior del matraz de destilación. La columna mejora la separación al proporcionar un área de superficie más grande para que el vapor y el condensado entren en contacto. Esto ayuda a que permanezca en equilibrio el mayor tiempo posible. La columna puede incluso consistir en pequeños subsistemas ('placas' o 'platos') que contienen una mezcla líquida enriquecida y en ebullición, todas con su propio equilibrio vapor-líquido.
Existen diferencias entre las columnas de fraccionamiento a escala de laboratorio y a escala industrial, pero los principios son los mismos. Ejemplos de columnas de fraccionamiento a escala de laboratorio (para aumentar la eficiencia) incluyen
- Condensador de aire
- Columna Vigreux (usualmente a escala de laboratorio solamente)
- Columna empacada (empacada con cuentas de vidrio, piezas de metal u otro material químicamente inerte)
- Sistema de destilación de banda giratoria.
Destilación a escala de laboratorio
Resumir
Contexto

Las destilaciones a escala de laboratorio se realizan casi exclusivamente como destilaciones por lotes. El dispositivo utilizado en la destilación, a veces referido como un destilador, consiste en un mínimo de un rehervidor o caldera en la que el material fuente se calienta, un condensador en el que la calienta vapor se enfría de nuevo al líquido estado, y un receptor en el cual el líquido concentrado o purificado, llamado el destilado, se recoge. Existen varias técnicas a escala de laboratorio para la destilación (véase también tipos de destilación).
Destilación simple
En la destilación simple, el vapor se canaliza inmediatamente a un condensador. En consecuencia, el destilado no es puro, sino que su composición es idéntica a la composición de los vapores a la temperatura y presión dadas. Esa concentración sigue la ley de Raoult.
Como resultado, la destilación simple es efectiva solo cuando los puntos de ebullición del líquido difieren mucho (la regla de oro es 25 °C)[25] o al separar líquidos de sólidos o aceites no volátiles. Para estos casos, las presiones de vapor de los componentes suelen ser lo suficientemente diferentes como para que el destilado pueda ser lo suficientemente puro para su propósito previsto.
Destilación fraccionada
En muchos casos, los puntos de ebullición de los componentes en la mezcla serán lo suficientemente cercanos como para que se tenga en cuenta la ley de Raoult. Por lo tanto, se debe usar la destilación fraccionada para separar los componentes mediante ciclos repetidos de vaporización-condensación dentro de una columna de fraccionamiento empaquetada. Esta separación, por destilaciones sucesivas, también se conoce como rectificación.[26]
A medida que se calienta la solución a purificar, sus vapores ascienden a la columna de fraccionamiento. A medida que se eleva, se enfría, condensándose en las paredes del condensador y en las superficies del material de embalaje. Aquí, el condensado continúa siendo calentado por los vapores ascendentes; se vaporiza una vez más. Sin embargo, la composición de los vapores frescos está determinada una vez más por la ley de Raoult. Cada ciclo de vaporización-condensación (llamada placa teórica ) producirá una solución más pura del componente más volátil.[27] En realidad, cada ciclo a una temperatura dada no ocurre exactamente en la misma posición en la columna de fraccionamiento; la placa teórica es, pues, un concepto más que una descripción precisa.
Más placas teóricas conducen a mejores separaciones. Un sistema de destilación de banda giratoria utiliza una banda giratoria de teflón o metal para forzar a los vapores ascendentes a estar en contacto cercano con el condensado descendente, lo que aumenta el número de placas teóricas.[28]
Destilación por arrastre de vapor
Al igual que la destilación al vacío, la destilación por arrastre de vapor es un método para destilar compuestos que son sensibles al calor.[29] La temperatura del vapor es más fácil de controlar que la superficie de un elemento de calefacción y permite una alta tasa de transferencia de calor sin calentamiento a una temperatura muy alta. Este proceso implica burbujear vapor a través de una mezcla caliente de la materia prima. Según la ley de Raoult, parte del compuesto objetivo se vaporizará (de acuerdo con su presión parcial). La mezcla de vapor se enfría y se condensa, generalmente produciendo una capa de aceite y una capa de agua.
La destilación al vapor de varias hierbas y flores aromáticas puede dar como resultado dos productos; un aceite esencial, así como uno destilado de hierbas acuoso. Los aceites esenciales se usan a menudo en perfumería y aromaterapia, mientras que los destilados acuosos tienen muchas aplicaciones en aromaterapia, procesamiento de alimentos y cuidado de la piel.


1: Barra agitadora / gránulos antigolpes 2: Balón 3: Columna de fraccionamiento 4: Termómetro / Temperatura de punto de ebullición 5: Grifo de teflón 1 6: Dedo frío 7: Agua de enfriamiento 8: Agua de enfriamiento en 9: Grifo de teflón 2 10: Vacío / entrada de gas 11: Grifo de teflón 3 12: Receptor de destilado
Destilación al vacío
Algunos compuestos tienen puntos de ebullición muy altos. Para hervir tales compuestos, a menudo es mejor disminuir la presión a la que se hierven tales compuestos en lugar de aumentar la temperatura. Una vez que se reduce la presión a la presión de vapor del compuesto (a la temperatura dada), puede comenzar la ebullición y el resto del proceso de destilación. Esta técnica se conoce como destilación al vacío y se encuentra comúnmente en el laboratorio en forma de evaporador rotatorio.
Esta técnica también es muy útil para compuestos que hierven más allá de su temperatura de descomposición a presión atmosférica y que, por lo tanto, se descompondrían por cualquier intento de hervirlos bajo presión atmosférica.
La destilación molecular es una destilación al vacío por debajo de la presión de 0,01 torr. 0.01 torr es un orden de magnitud por encima del alto vacío, donde los fluidos están en el régimen de flujo molecular libre, es decir, la trayectoria libre media de las moléculas es comparable al tamaño del equipo. La fase gaseosa ya no ejerce una presión significativa sobre la sustancia a evaporar, y en consecuencia, la velocidad de evaporación ya no depende de la presión. Es decir, debido a que los supuestos continuos de la dinámica de fluidos ya no se aplican, el transporte de masas se rige por la dinámica molecular en lugar de la dinámica de fluidos. Por lo tanto, es necesario un camino corto entre la superficie caliente y la superficie fría, típicamente suspendiendo una placa caliente cubierta con una película de alimentación junto a una placa fría con una línea de visión en el medio. La destilación molecular se utiliza industrialmente para la purificación de aceites.
Destilación al vacío sensible al aire
Algunos compuestos tienen altos puntos de ebullición además de ser sensibles al aire. Se puede usar un sistema simple de destilación al vacío como se ejemplificó anteriormente, por lo que el vacío se reemplaza con un gas inerte después de que se complete la destilación. Sin embargo, este es un sistema menos satisfactorio si uno desea recolectar fracciones bajo una presión reducida. Para hacer esto, se puede agregar un adaptador de "vaca" o "cerdo" al extremo del condensador, o para obtener mejores resultados o para compuestos muy sensibles al aire, se puede usar un aparato de triángulo Perkin.
El triángulo de Perkin tiene medios a través de una serie de grifos de vidrio o teflón para permitir que las fracciones se aíslen del resto del alambique, sin que el cuerpo principal de la destilación se extraiga del vacío o de la fuente de calor, y así pueda permanecer en un estado de reflujo. Para hacer esto, primero se aísla la muestra del vacío por medio de los grifos, luego se reemplaza el vacío sobre la muestra con un gas inerte (como nitrógeno o argón) y luego se puede tapar y eliminar. Luego, se puede agregar un nuevo recipiente de recolección al sistema, evacuarlo y volver a conectarlo al sistema de destilación a través de los grifos para recolectar una segunda fracción, y así sucesivamente, hasta que se hayan recolectado todas las fracciones.
Destilación de corto recorrido
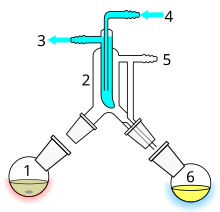
La destilación de corto recorrido es una técnica de destilación que implica que el destilado se desplace una distancia corta, a menudo solo unos pocos centímetros, y normalmente se realiza a presión reducida.[30] Un ejemplo clásico sería una destilación que involucre el destilado que viaja de un bulbo de vidrio a otro, sin la necesidad de un condensador que separe las dos cámaras. Esta técnica se usa a menudo para compuestos que son inestables a altas temperaturas o para purificar pequeñas cantidades de compuesto. La ventaja es que la temperatura de calentamiento puede ser considerablemente más baja (a presión reducida) que el punto de ebullición del líquido a presión estándar, y el destilado solo tiene que viajar una corta distancia antes de condensarse. Un camino corto asegura que se pierda poco compuesto en los lados del aparato. El Kugelrohr es una especie de aparato de destilación de corto recorrido que a menudo contiene múltiples cámaras para recoger las fracciones del destilado.
Destilación de zona
La destilación de zona es un proceso de destilación en un recipiente largo con fusión parcial de materia refinada en la zona de líquido en movimiento y condensación de vapor en la fase sólida al tirar el condensado en un área fría. Cuando el calentador de zona se está moviendo desde la parte superior a la parte inferior del contenedor, se está formando un condensado sólido con una distribución de impurezas irregular. Luego, la parte más pura del condensado se puede extraer como producto. El proceso puede repetirse muchas veces moviendo (sin rotación) el condensado recibido a la parte inferior del contenedor en el lugar de la materia refinada. La distribución irregular de impurezas en el condensado (es decir, la eficiencia de la purificación) aumenta con el número de repeticiones del proceso. La destilación de zonas es un análogo de destilación de la recristalización de zonas. La distribución de impurezas en el condensado se describe mediante ecuaciones conocidas de recristalización de zona con varios números de iteración del proceso, con una distribución de reemplazo eficiente de la cristalización en el factor de separación α de la destilación.[31][32][33]
Otros tipos
- El proceso de destilación reactiva implica utilizar el recipiente de reacción como alambique. En este proceso, el producto generalmente tiene un punto de ebullición más bajo que sus reactivos. A medida que el producto se forma a partir de los reactivos, se vaporiza y se elimina de la mezcla de reacción. Esta técnica es un ejemplo de un proceso continuo frente a un proceso por lotes; las ventajas incluyen menos tiempo de inactividad para cargar el recipiente de reacción con material de partida y menos trabajo. La destilación "sobre un reactivo" podría clasificarse como una destilación reactiva. Normalmente se utiliza para eliminar impurezas volátiles de la alimentación de distalación. Por ejemplo, se puede agregar un poco de cal para eliminar el dióxido de carbono del agua, seguido de una segunda destilación con un poco de ácido sulfúrico para eliminar los restos de amoníaco.
- La destilación catalítica es el proceso por el cual los reactivos se catalizan mientras se destilan para separar continuamente los productos de los reactivos. Este método se utiliza para ayudar a que las reacciones de equilibrio se completen.
- La vaporización es un método para la separación de mezclas de líquidos mediante vaporización parcial a través de una membrana no porosa.
- La destilación extractiva se define como la destilación en presencia de un componente miscible, de alto punto de ebullición y relativamente no volátil, el solvente, que no forma azeótropo con los otros componentes en la mezcla.
- La evaporación instantánea (o evaporación parcial) es la vaporización parcial que se produce cuando una corriente de líquido saturado sufre una reducción de la presión al pasar a través de una válvula de estrangulamiento u otro dispositivo de estrangulamiento. Este proceso es una de las operaciones unitarias más simples, siendo equivalente a una destilación con una sola etapa de equilibrio.
- La codestilación es una destilación que se realiza en mezclas en las que los dos compuestos no son miscibles. En el laboratorio, el aparato Dean-Stark se usa para este fin para eliminar el agua de los productos de síntesis. El Bleidner es otro ejemplo con dos solventes de reflujo.
- La destilación por membrana es un tipo de destilación en la que los vapores de una mezcla a separar se pasan a través de una membrana, que impregna selectivamente un componente de la mezcla. La diferencia de presión de vapor es la fuerza motriz. Tiene aplicaciones potenciales en la desalinización de agua de mar y en la eliminación de componentes orgánicos e inorgánicos.
El proceso unitario de evaporación también se puede llamar "destilación":
- En la evaporación rotatoria , se utiliza un aparato de destilación al vacío para eliminar los disolventes a granel de una muestra. Típicamente, el vacío es generado por un aspirador de agua o una bomba de membrana.
- En un kugelrohr se utiliza típicamente un aparato de destilación de corto recorrido (generalmente en combinación con un (alto) vacío) para destilar alto punto de ebullición (> 300 °C) compuestos. El aparato consiste en un horno en el que se coloca el compuesto a destilar, una parte de recepción que está fuera del horno y un medio de rotación de la muestra. El vacío se genera normalmente utilizando una bomba de alto vacío.
Otros usos:
- La destilación seca o destilación destructiva , a pesar del nombre, no es realmente destilación, sino una reacción química conocida como pirólisis en la cual las sustancias sólidas se calientan en una atmósfera inerte o reductora y cualquier fracción volátil, que contiene líquidos de alto punto de ebullición y productos de pirólisis. se recogen. La destilación destructiva de la madera para producir metanol es la raíz de su nombre común: el alcohol de madera .
- La destilación por congelación es un método análogo de purificación que utiliza la congelación en lugar de la evaporación. No es realmente una destilación, sino una recristalización en la que el producto es el licor madre y no produce productos equivalentes a la destilación. Este proceso se utiliza en la producción de cerveza helada y vino de hielo para aumentar el contenido de etanol y azúcar, respectivamente. También se utiliza para producir applejack. A diferencia de la destilación, la destilación por congelación concentra congéneres venenosos en lugar de eliminarlos; como resultado, muchos países prohíben el applejack como medida de salud. Sin embargo, reducir el metanol con la absorción del tamiz molecular 4A es un método práctico para la producción.[34] Además, la destilación por evaporación puede separarlos ya que tienen diferentes puntos de ebullición.
Destilación azeotrópica
Resumir
Contexto
Las interacciones entre los componentes de la solución crean propiedades únicas para la solución, ya que la mayoría de los procesos conllevan mezclas no ideales, donde la ley de Raoult no se cumple. Tales interacciones pueden dar como resultado un azeótropo de ebullición constante que se comporta como si fuera un compuesto puro (es decir, hierve a una temperatura única en lugar de un rango). En un azeótropo, la solución contiene el componente dado en la misma proporción que el vapor, de modo que la evaporación no cambia la pureza y la destilación no efectúa la separación. Por ejemplo, el alcohol etílico y el agua forman un azeótropo de 95.6% a 78.1 °C.
Si el azeótropo no se considera suficientemente puro para su uso, existen algunas técnicas para romper el azeótropo para dar un destilado puro. Este conjunto de técnicas se conoce como destilación azeotrópica. Algunas técnicas logran esto "saltando" sobre la composición azeotrópica (agregando otro componente para crear un nuevo azeótropo, o variando la presión). Otros trabajan mediante la eliminación química o física o el secuestro de la impureza. Por ejemplo, para purificar etanol más allá del 95%, se puede agregar un agente de secado (o desecante, como el carbonato de potasio) para convertir el agua soluble en agua insoluble de cristalización. Los tamices moleculares a menudo también se utilizan para este propósito.
Los líquidos inmiscibles, como el agua y el tolueno, forman azeótropos fácilmente. Comúnmente, estos azeótropos se conocen como un azeótropo de bajo punto de ebullición porque el punto de ebullición del azeótropo es más bajo que el punto de ebullición de cualquiera de los componentes puros. La temperatura y la composición del azeótropo se predicen fácilmente a partir de la presión de vapor de los componentes puros, sin el uso de la ley de Raoult. El azeótropo se rompe fácilmente en una configuración de destilación utilizando un separador líquido-líquido (un decantador) para separar las dos capas líquidas que se condensan en la parte superior. Solo una de las dos capas líquidas se somete a reflujo a la configuración de destilación.
También existen azeótropos de alto punto de ebullición, como una mezcla del 20 por ciento en peso de ácido clorhídrico en agua. Como lo indica el nombre, el punto de ebullición del azeótropo es mayor que el punto de ebullición de cualquiera de los componentes puros.
Para romper las destilaciones azeotrópicas y los límites de destilación cruzada, como en el Problema DeRosier, es necesario aumentar la composición de la tecla de luz en el destilado.
Ruptura de un azeótropo por manipulación de presión unidireccional
Los puntos de ebullición de los componentes en un azeótropo se superponen para formar una banda. Al exponer un azeótropo a un vacío o presión positiva, es posible desviar el punto de ebullición de un componente lejos del otro explotando las diferentes curvas de presión de vapor de cada uno; las curvas pueden superponerse en el punto azeotrópico, pero es poco probable que sigan siendo idénticas a lo largo del eje de presión a cada lado del punto azeotrópico. Cuando el sesgo es lo suficientemente grande, los dos puntos de ebullición ya no se superponen y la banda azeotrópica desaparece.
Este método puede eliminar la necesidad de agregar otros productos químicos a una destilación, pero tiene dos inconvenientes potenciales.
Bajo presión negativa, se necesita energía para una fuente de vacío y los puntos de ebullición reducidos de los destilados requieren que el condensador se enfríe para evitar que los vapores de destilados se pierdan en la fuente de vacío. Las mayores demandas de enfriamiento a menudo requerirán energía adicional y posiblemente un equipo nuevo o un cambio de refrigerante.
Alternativamente, si se requieren presiones positivas, no se puede usar material de vidrio estándar, se debe usar energía para la presurización y hay una mayor probabilidad de que ocurran reacciones secundarias en la destilación, como la descomposición, debido a las temperaturas más altas requeridas para efectuar la ebullición.
Una destilación unidireccional dependerá de un cambio de presión en una dirección, ya sea positiva o negativa.
Destilación por presión
La destilación por oscilación a presión es esencialmente la misma que la destilación unidireccional utilizada para romper mezclas azeotrópicas, pero aquí se pueden emplear presiones tanto positivas como negativas.
Esto mejora la selectividad de la destilación y permite que un químico optimice la destilación al evitar los extremos de presión y temperatura que desperdician energía. Esto es particularmente importante en aplicaciones comerciales.
Un ejemplo de la aplicación de la destilación por oscilación a presión es durante la purificación industrial del acetato de etilo después de su síntesis catalítica a partir de etanol.
Destilación industrial
Resumir
Contexto

Las aplicaciones de destilación industrial a gran escala incluyen destilación fraccionada por lotes y continua, destilación al vacío, azeotrópica, extractiva y por vapor. Las aplicaciones industriales más utilizadas para la destilación fraccionada continua y en estado estacionario son las refinerías de petróleo, plantas petroquímicas y químicas y plantas de procesamiento de gas natural.
Para controlar y optimizar dicha destilación industrial, se establece un método de laboratorio estandarizado, ASTM D86. Este método de prueba se extiende a la destilación atmosférica de productos derivados del petróleo utilizando una unidad de destilación por lotes de laboratorio para determinar cuantitativamente las características del rango de ebullición de los productos derivados del petróleo.
La destilación industrial[26][35] se realiza típicamente en grandes columnas cilíndricas verticales conocidas como torres de destilación o columnas de destilación con diámetros que varían de aproximadamente 65 centímetros a 16 metros y alturas que van desde unos 6. metros a 90 metros o más. Cuando la alimentación del proceso tiene una composición diversa, como en la destilación de petróleo crudo, las salidas de líquido a intervalos hasta la columna permiten la extracción de diferentes fracciones o productos que tienen diferentes puntos de ebullición o rangos de ebullición. Los productos "más ligeros" (aquellos con el punto de ebullición más bajo) salen de la parte superior de las columnas y los productos "más pesados" (los que tienen el punto de ebullición más alto) salen de la parte inferior de la columna y, a menudo, se denominan fondos.

Las torres industriales utilizan el reflujo para lograr una separación más completa de los productos. El reflujo se refiere a la porción del producto líquido condensado de la parte superior de una torre de destilación o fraccionamiento que se devuelve a la parte superior de la torre como se muestra en el diagrama esquemático de una torre de destilación industrial típica a gran escala. Dentro de la torre, el líquido de reflujo descendente proporciona enfriamiento y condensación de los vapores ascendentes, lo que aumenta la eficiencia de la torre de destilación. Cuanto más reflujo se proporciona para un número dado de placas teóricas, mejor es la separación de la torre de los materiales de bajo punto de ebullición de los materiales de mayor punto de ebullición. Alternativamente, cuanto más reflujo se proporcione para una separación deseada dada, menor será el número de placas teóricas requeridas. Los ingenieros químicos deben elegir qué combinación de velocidad de reflujo y número de placas es económica y físicamente factible para los productos purificados en la columna de destilación.
Estas torres de fraccionamiento industriales también se utilizan en la separación criogénica del aire, produciendo oxígeno líquido, nitrógeno líquido y argón de alta pureza. La destilación de clorosilanos también permite la producción de silicio de alta pureza para su uso como semiconductor. El diseño y el funcionamiento de una torre de destilación dependen de la alimentación y de los productos deseados. Dada una alimentación simple de componentes binarios, se pueden utilizar métodos analíticos como el método de McCabe-Thiele[26][36] o la ecuación de Fenske.[26] Para una alimentación de múltiples componentes, los modelos de simulación se utilizan tanto para el diseño como para la operación. Además, las eficiencias de los dispositivos de contacto vapor-líquido (denominados "placas" o "bandejas") utilizadas en las torres de destilación son típicamente más bajas que las de una etapa de equilibrio teóricamente eficiente al 100%. Por lo tanto, una torre de destilación necesita más bandejas que el número de etapas de equilibrio vapor-líquido teóricas. Se ha postulado una variedad de modelos para estimar las eficiencias de la bandeja.

En los usos industriales modernos, se utiliza un material de embalaje en la columna en lugar de bandejas cuando se requieren bajas caídas de presión a través de la columna. Otros factores que favorecen el empaque son: sistemas de vacío, columnas de diámetro más pequeño, sistemas corrosivos, sistemas propensos a la formación de espuma, sistemas que requieren un bajo nivel de retención de líquidos y destilación por lotes. A la inversa, los factores que favorecen las columnas de placas son: presencia de sólidos en la alimentación, altas tasas de líquidos, grandes diámetros de columna, columnas complejas, columnas con amplia variación en la composición de la alimentación, columnas con una reacción química, columnas de absorción, columnas limitadas por la tolerancia del peso de la cimentación, baja Tasa de líquido, gran relación de reducción y procesos sujetos a aumentos de procesos.

Este material de empaque puede ser empaquetado volcado al azar (1–3 "de ancho) como anillos Raschig o chapa metálica estructurada. Los líquidos tienden a humedecer la superficie del empaque y los vapores pasan a través de esta superficie húmeda, donde tiene lugar la transferencia de masa. A diferencia de la destilación de bandejas convencional en la que cada bandeja representa un punto separado de equilibrio vapor-líquido, la curva de equilibrio vapor-líquido en una columna empaquetada es continua. Sin embargo, al modelar columnas empaquetadas, es útil calcular varias "etapas teóricas" para denotar la eficiencia de separación de la columna empaquetada con respecto a las bandejas más tradicionales. Las empaquetaduras de diferentes formas tienen diferentes áreas de superficie y espacios vacíos entre las empaquetaduras. Ambos factores afectan el rendimiento del embalaje.
Otro factor además de la forma del empaque y el área de la superficie que afecta el rendimiento del empaque aleatorio o estructurado es la distribución de líquido y vapor que ingresa al lecho empaquetado. El número de etapas teóricas requeridas para hacer una separación dada se calcula utilizando una relación específica de vapor a líquido. Si el líquido y el vapor no están distribuidos uniformemente a través del área de la torre superficial cuando ingresa al lecho empacado, la relación de líquido a vapor no será correcta en el lecho empacado y no se logrará la separación requerida. El embalaje parecerá no funcionar correctamente. La altura equivalente a una placa teórica (HETP) será mayor que la esperada. El problema no es el embalaje en sí, sino la mala distribución de los fluidos que entran en el lecho lleno. La mala distribución del líquido es más frecuente el problema que el vapor. El diseño de los distribuidores de líquidos utilizados para introducir la alimentación y el reflujo en un lecho empacado es fundamental para que el empaque funcione con la máxima eficiencia. En las referencias se pueden encontrar métodos para evaluar la efectividad de un distribuidor de líquidos para distribuir uniformemente el líquido que ingresa en un lecho empacado.[38][39] Fractionation Research, Inc. (comúnmente conocido como FRI) ha realizado un trabajo considerable sobre este tema.[40]
Destilación multiefecto
El objetivo de la destilación de efectos múltiples es aumentar la eficiencia energética del proceso, para su uso en desalinización o, en algunos casos, una etapa en la producción de agua ultrapura. El número de efectos es inversamente proporcional al kW·h/m³ de agua recuperada, y se refiere al volumen de agua recuperada por unidad de energía en comparación con la destilación de efecto simple. Un efecto es aproximadamente 636 kW·h/m 3 .
- Ls destilación de flash de varias etapas puede lograr más de 20 efectos con la entrada de energía térmica, como se menciona en el artículo.
- Evaporación por compresión de vapor (según los fabricantes) las unidades comerciales a gran escala pueden lograr alrededor de 72 efectos con la entrada de energía eléctrica.
Hay muchos otros tipos de procesos de destilación de efectos múltiples, incluido uno denominado simplemente destilación de efectos múltiples (MED), en el que se emplean cámaras múltiples, con intercambiadores de calor intermedios.
Destilación en la elaboración de alimentos
Bebidas destiladas
Los materiales vegetales que contienen carbohidratos se dejan fermentar, produciendo una solución diluida de etanol en el proceso. Las bebidas espirituosas como el whisky y el ron se preparan mediante la destilación de estas soluciones diluidas de etanol. Los componentes distintos del etanol, incluidos el agua, los ésteres y otros alcoholes, se recogen en el condensado, lo que explica el sabor de la bebida. Algunas de estas bebidas se almacenan en barriles u otros recipientes para adquirir más compuestos de sabor y sabores característicos.
Galería
 |
La química en sus inicios utilizó retortas como equipo de laboratorio exclusivamente para procesos de destilación. |
 |
Una configuración simple para destilar tolueno seco y libre de oxígeno. |
 |
Diagrama de una columna de destilación al vacío a escala industrial como se usa comúnmente en las refinerías de petróleo |
 |
Un evaporador rotativo es capaz de destilar solventes más rápidamente a temperaturas más bajas mediante el uso de un vacío . |
 |
Destilación mediante aparato de semi-microescala. El diseño sin juntas elimina la necesidad de encajar piezas. El matraz en forma de pera permite eliminar la última gota de residuo, en comparación con un matraz de fondo redondo de tamaño similar. El pequeño volumen de retención previene las pérdidas. Se usa un cerdo para canalizar los diversos destilados en tres matraces receptores. Si es necesario, la destilación puede llevarse a cabo al vacío utilizando el adaptador de vacío en el cerdo. |
Véase también
- Destilación atmosférica de petróleo crudo
- Clyssus
- Extracción de fragancia
- Microdistilería
- Sublimación
- Anillos de Dixon
- Embalaje de columna al azar
Referencias
Fuentes citadas
Otras lecturas
Enlaces externos
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
