Regla de Markovnikov
De Wikipedia, la enciclopedia libre
De Wikipedia, la enciclopedia libre
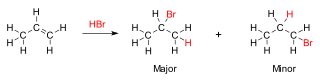
En fisicoquímica orgánica, la regla de Markóvnikov es una observación respecto a la reacción de adición electrófila. Fue formulada por el químico ruso Vladímir Markóvnikov en 1870.[1][2] En una reacción química encontrada particularmente en química orgánica, la regla establece que, con la adición de un reactivo asimétrico del tipo H-X(regularmente un hidrácido) a un alqueno o alquino, el átomo de hidrógeno lábil se une al átomo de carbono del doble o triple enlace con el mayor número de átomos de hidrógeno, y el grupo halogenuro (X) se une al átomo de carbono del doble o triple enlace con el menor número de átomos de hidrógeno.[3]
Lo mismo es verdad cuando un alqueno reacciona con agua en una reacción catalizada por ácidos minerales, para producir alcoholes. El grupo hidroxilo (OH) se une al átomo de carbono que tiene el mayor número de enlaces carbono-carbono, mientras que el átomo de hidrógeno se une al átomo de carbono en el otro extremo del enlace doble, el que tiene el mayor número de enlaces carbono-hidrógeno.
La base química para la regla de Markóvnikov es la formación del carbocatión más estable, durante el proceso de adición. La adición del átomo de hidrógeno a uno de los átomos de carbono origina una carga formal positiva en el otro átomo de carbono, formando un carbocatión intermediario. Mientras más sustituido está un carbocatión (más enlaces tiene a otro átomos de carbono u otros sustituyentes electrodonantes), más estable es, debido al efecto inductivo, hiperconjugación e impedimento estérico. El producto principal de la reacción de adición será el que tenga el intermediario más estable. En consecuencia, el producto principal de la adición del HX (donde X es un halógeno, átomo o grupo funcional más electronegativo que el átomo de hidrógeno) a un alqueno tiene el átomo de hidrógeno en la posición menos sustituida y el grupo X en la posición más sustituidas. Es importante notar que, sin embargo, también se formará el carbocatión menos estable, aunque en menor grado, y procederá a formar el producto minoritario con la disposición de átomos en forma opuesta.
Como una mnemotécnica, se puede sumarizar en "el rico se hace más rico y el pobre se hace más pobre": un átomo de carbono rico en sustituyentes ganará más sustituyentes, y el átomo de carbono con más átomos de hidrógeno unidos ganará más átomos de hidrógeno.
Una de las reacciones orgánicas en las que Markóvnikov basó su regla fue la que se da entre el yoduro de hidrógeno con el bromuro de vinilo (efectuada por primera vez en 1865). En otra manifestación de su regla, observó que el átomo de halógeno se unió al átomo de carbono que ya llevaba un átomo de halógeno. La hidrólisis de halogenuros germinales del producto inicial de reacción con óxido de plata húmedo o hidrogenado a etanal probó que la sustitución era 1,1.

Se ha observado[2] que la publicación original de Markóvnikov de 1869 era superficial y que no hizo mucho trabajo experimental por él mismo. La regla en sí apareció sólo como una nota al pie de cuatro páginas en un artículo de 26 páginas,lo que puede ayudar a explicar por qué tomó 60 años que su regla fuera aceptada.
Cuando el mecanismo seguido por la reacción impide la formación de un intermediario carbocatión, la reacción puede seguir otros mecanismos que también son regioselectivos, pero en contra de las predicciones de la regla de Markóvnikov, como la adición radicalaria. Se dice que tales reacciones son anti-Markóvnikov, dado que el átomo de hidrógeno se une al átomo de carbono más sustituido. Esta reacción es exactamente opuesta a la reacción de Markóvnikov en cuanto a sus resultados, y de ahí el nombre. Nuevamente, del mismo modo que con la carga positiva, el radical es más estable cuando está en la posición más sustituida.
El comportamiento anti-Markóvnikov se extiende a otras reacciones químicas distintas a las simples adiciones a los alquenos. Una manifestación anti-Markóvnikov se observa en la hidratación del fenilacetileno que, catalizado con oro, produce la acetofenona esperada, pero con un catalizador especial de rutenio[4] el otro regioisómero 2-fenilacetaldehído:[5]

El comportamiento anti-Markóvnikov también se puede manifestar en ciertas reacciones de transposición. En una sustitución nucleofílica formal catalizada por cloruro de titanio (IV) en el compuesto 1 enantiopuro en el esquema seguido, se forman los dos productos racémicos 2a y 2b:[6]

Esta distribución del producto puede ser racionalizada asumiendo que la pérdida del grupo hidroxilo en 1 produce el carbocatión terciario A, que se rearregla al aparentemente menos estable carbocatión secundario B. El cloro puede aproximarse a este centro desde las dos caras, conduciendo a la mezcla observada de isómeros
Sin embargo, tal vez el ejemplo más conocido de adición anti-Markóvnikov es la hidroboración.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.