Loading AI tools
De Wikipedia, la enciclopedia libre
La Reacción de Zincke es una reacción orgánica en la cual una piridina es transformada en una sal de piridinio por reacción con 2,4-dinitro-clorobenceno y una amina primaria. La reacción fue nombrada en honor a Theodor Zincke.[1][2][3]

La reacción Zincke no se debe confundir con la reacción de Zincke-Suhl o la nitración de Zincke. Por otra parte, la reacción Zincke no tiene nada que ver con el zinc elemento químico.
La primera reacción es la formación de la sal de N-2,4-dinitrofenil-piridinio (2). Esta sal se puede aislar y purificar por recristalización.

Si se calienta una amina primaria con la sal de N-2 ,4-dinitrofenil-piridinio (2), la adición de la amina provoca la apertura del anillo de piridinio. Una segunda adición de la amina conduce al desplazamiento de la 2,4-dinitroanilina (5) y la formación de la sal de König.[4] (6a y 6b). El isómero trans-cis-trans de la sal König (6a) puede reaccionar ya sea por transposición sigmatrópica o por adición nucleofílica de un intermediario zwitteriónico para dar el intermediario cíclico (7).[5] Se ha propuesto que este es el paso determinante de la velocidad.[6][7] Después de la transferencia de protones y la eliminación de aminas, se forma el ion piridinio deseado (9).

Este mecanismo puede ser referido como un caso de Adición Nucleofílica (AN), Apertura de Anillo y Cierre de Anillo (ANRORC, por sus siglas en inglés).
En una aplicación en la síntesis de fase sólida, la amina forma una unión covalente a una resina de Wang.[8]

Otro ejemplo es la síntesis de una sal quiral de isoquinolinio.[9]

Los aldehídos de Zincke, o 5-aminopenta-2,4-dienales, son el producto de una sal de piridinio con dos equivalentes de una amina secundaria, seguida de hidrólisis básica. Utilizando aminas secundarias se produce la reacción de Zincke.[1][2][3] El uso de bromuro de cianógeno para la activación de la piridina fue reportado de manera independiente por W. König:[10]

La síntesis y utilidad de aldehídos de Zincke ha sido ampliamente estudiada.[11][12][13]
Una variación de la reacción de Zincke ha sido aplicada en la síntesis de nuevos indoles:[14]

en donde se utiliza bromuro de cianógeno mediado por la activación de la piridina (método de König).
Más recientemente, una transposición interesante de los aldehídos de Zincke a amidas insaturadas con conformación Z fue descubierta por accidente mientras trataba de efectuar una reacción de Diels-Alder intramolecular.[15] La transposición se lleva a cabo como un producto Z estereospecífico. En un documento de seguimiento, fueron utilizadas aminas alílicas y se obtuvieron los productos de una transposición en cascada y una intramolecular de Diels-Alder.[16] Los detalles del mecanismo fueron discutidos, y revelaron un mecanismo inusual con una cetena vinílica calculado por medio de estudios computacionales.[17]


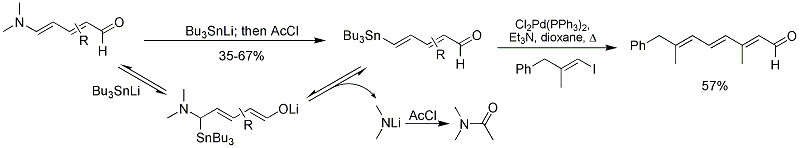
El grupo de Vanderwal ha reportado la síntesis de 4-estannildienales de aldehídos de Zincke por adición de un anión tributilestannilo y cloruro de acetilo.[18] Los productos son sustratos útiles para reacciones de copulación de Stille] para sintetizar polienos.
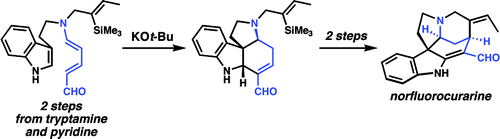
En 2009, el grupo de Vanderwal[19] reportó otra reacción de transposición de los aldehídos de Zincke. Los aldehídos de Zincke derivados de la triptamina se calientan con una base fuerte para dar un aldehído insaturado. Esta reacción fue el paso clave en la síntesis total de la fluoronorcurarina, un alcaloide del estricnano.[20] Esta estrategia ha sido empleada también en la síntesis más corta reportada de la estricnina, con tan sólo 6 pasos.[21] This works has been highlighted on the blog Totally Synthetic.
Se compara la Síntesis clásica de la estricnina:
Y la síntesis de la estricnina de Vanderwal

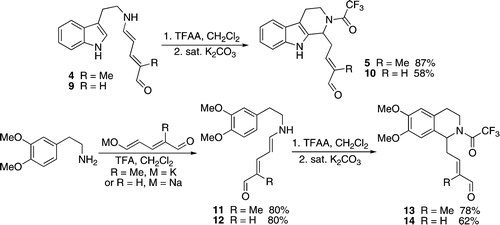
Los primeros reportes de los aldehídos de Zincke participando en una reacción de Pictet-Spengler aparecieron del grupo de Delpech y posteriormente Christian Marazano.[22] Esta reacción produjo tanto tetrahidro-β-carbolinas como tetrahidroisoquinolinas. Estas estructuras se encuentran en productos naturales alcaloides, y han sido utilizadas en su síntesis total. A continuación se muestra Una reacción de Pictet−Spengler sobre el N-cilo por tratamiento de triptamina y homoveratrilamina derivada de aminopentadienales con TFAA:
Uno de los inconvenientes de la síntesis de aldehídos de Zincke es la necesidad de 2 equivalentes de una amina en la reacción de apertura del anillo de piridina inicial. Esto es de particular interés para el caso de aminas secundarias complejas requeridas para la síntesis de productos naturales. El grupo de Michel ha descubierto recientemente una síntesis alternativa por la condensación en una variedad de derivados del glutaconaldehído con TFA. Esta solución ha simplificado enormemente la producción y purificación del complejo de los aldehídos Zincke.[23]
En 2006 y 2007 la reacción Zincke fue “redescubierta” por un grupo de investigadores en Japón[24] e independientemente, por un grupo de estadounidenses.[25] Ambos grupos reportararon la síntesis de un diaza-anuleno de 12 miembros (estructura 1) de cloruro de N-aril piridinio y una amina, ya sea una amina alifática (reportada por los norteamericanos) o una anilina (reportada por los japoneses).
En una carta a Angewandte Chemie, el químico alemán Manfred Christl[26] señaló no sólo que la “nueva” reacción era en realidad la reacción de Zincke reportada 100 años antes, sino también que la estructura propuesta para el producto de reacción no era el anillo de 12 miembros, sino la sal de piridinio de 6 miembros (estructura 2). Inicialmente ambos grupos admitieron que habían ignorado la literatura existente sobre Zincke, pero se aferraron a que los resultados de la estructura del anuleno, sobre la base de la ionización por electrospray (ESI), demuestran claramente que es un dímero. En su carta, Christl comentó que en las mediciones de ESI asociación de moléculas es un fenómeno común. Además, señaló las similitudes en el punto de fusión y la espectroscopia de RMN.
En diciembre de 2007 el grupo japonés se retractó de su papel en las cartas orgánicas debido a las incertidumbres con respecto a qué productos se forman en la reacción descrita y el grupo de EE. UU. agregó una corrección a los suyos en el Angewandte Chemie indicando que “deseaban alterar la estructura propuesta para el anuleno[27] El asunto recibió la atención de los medios:[28][29]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.