Ωσμωτική πίεση
μέτρο της τάσης ενός διαλύματος να προσλαμβάνει καθαρό διαλύτη με ώσμωση From Wikipedia, the free encyclopedia
Remove ads
Remove ads
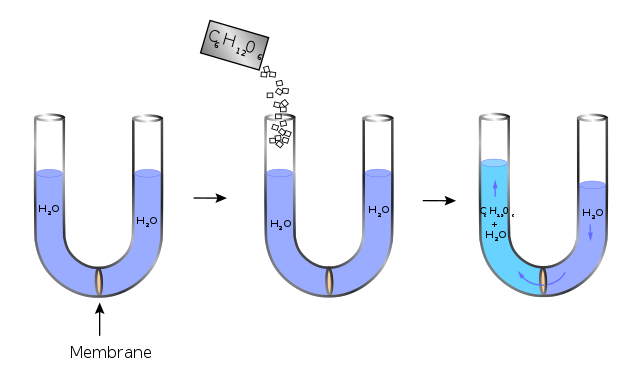
Ωσμωτική πίεση (Osmotic pressure) είναι η ελάχιστη πίεση που πρέπει να εφαρμοστεί σε ένα διάλυμα για να αποτραπεί η προς τα μέσα ροή του καθαρού διαλύτη του σε μια ημιπερατή μεμβράνη.[1] Ορίζεται επίσης ως το μέτρο της τάσης ενός διαλύματος να προσλαμβάνει τον καθαρό του διαλύτη με ώσμωση. Δυνητική οσμωτική πίεση (Potential osmotic pressure) είναι η μέγιστη ωσμωτική πίεση που θα μπορούσε να αναπτυχθεί σε ένα διάλυμα εάν διαχωριζόταν από τον καθαρό διαλύτη του με μια ημιπερατή μεμβράνη. Η ώσμωση συμβαίνει όταν δύο διαλύματα που περιέχουν διαφορετικές συγκεντρώσεις διαλυμένης ουσίας διαχωρίζονται από μια επιλεκτικά διαπερατή μεμβράνη. Τα μόρια του διαλύτη διέρχονται κατά προτίμηση μέσω της μεμβράνης από το διάλυμα χαμηλής συγκέντρωσης στο διάλυμα με υψηλότερη συγκέντρωση διαλυμένης ουσίας. Η μεταφορά των μορίων του διαλύτη θα συνεχιστεί μέχρι να επιτευχθεί η ωσμωτική ισορροπία.[1][2]
Remove ads
Θεωρία και μέτρηση

Ο Ιάκωβος Ερρίκος βαν'τ Χοφ βρήκε μια ποσοτική σχέση μεταξύ της ωσμωτικής πίεσης και της συγκέντρωσης διαλυμένης ουσίας, που εκφράζεται στην ακόλουθη εξίσωση:
όπου είναι η ωσμωτική πίεση, το i είναι ο αδιάστατος δείκτης Βαν'τ Χοφ, το c είναι η γραμμομοριακότητα κατ΄ όγκο της διαλυμένης ουσίας, το R είναι η παγκόσμια σταθερά των αερίων και το T είναι η απόλυτη θερμοκρασία (συνήθως σε Κέλβιν). Αυτός ο τύπος ισχύει όταν η συγκέντρωση της διαλυμένης ουσίας είναι αρκετά χαμηλή ώστε το διάλυμα να μπορεί να αντιμετωπιστεί ως ιδανικό διάλυμα. Η αναλογία προς τη συγκέντρωση σημαίνει ότι η ωσμωτική πίεση είναι μια προσθετική ιδιότητα. Σημειώστε την ομοιότητα αυτού του τύπου με τον νόμο των ιδανικών αερίων στη μορφή όπου n είναι ο συνολικός αριθμός γραμμομορίων των μορίων του αερίου στον όγκο V, και n/V είναι η γραμμομοριακή συγκέντρωση των μορίων του αερίου. Οι Harmon Northrop Morse και ο Frazer έδειξαν ότι η εξίσωση εφαρμόζεται σε πιο συμπυκνωμένα διαλύματα εάν η μονάδα συγκέντρωσης ήταν γραμμομοριακότητα κατά βάρος (molality) αντί γραμμομοριακότητα κατ΄ όγκο (molarity).[3] Έτσι, όταν χρησιμοποιείται η γραμμομοριακότητα κατά βάρος αυτή η εξίσωση έχει ονομαστεί εξίσωση Morse. Για πιο πυκνά διαλύματα, η εξίσωση van 't Hoff μπορεί να επεκταθεί ως δυναμοσειρά σε συγκέντρωση διαλυμένης ουσίας, c. Σε μια πρώτη προσέγγιση,
όπου είναι η ιδανική πίεση και το A είναι μια εμπειρική παράμετρος. Η τιμή της παραμέτρου A (και των παραμέτρων από προσεγγίσεις υψηλότερης τάξης) μπορεί να χρησιμοποιηθεί για τον υπολογισμό των παραμέτρων Pitzer. Οι εμπειρικές παράμετροι χρησιμοποιούνται για την ποσοτικοποίηση της συμπεριφοράς διαλυμάτων ιοντικών και μη ιοντικών διαλυμένων ουσιών που δεν είναι ιδανικά διαλύματα με τη θερμοδυναμική έννοια. Το κελί Pfeffer αναπτύχθηκε για τη μέτρηση της ωσμωτικής πίεσης.
Remove ads
Εφαρμογές

Η μέτρηση της ωσμωτικής πίεσης μπορεί να χρησιμοποιηθεί για τον προσδιορισμό των σχετικών μοριακών βαρών. Η ωσμωτική πίεση είναι ένας σημαντικός παράγοντας που επηρεάζει τα βιολογικά κύτταρα.[4] Η ωσμορρύθμιση (Osmoregulation) είναι ο μηχανισμός ομοιόστασης ενός οργανισμού για την επίτευξη ισορροπίας στην ωσμωτική πίεση.
- Υπερτονικότητα είναι η παρουσία ενός διαλύματος που προκαλεί τη συρρίκνωση των κυττάρων.
- Υποτονικότητα είναι η παρουσία ενός διαλύματος που προκαλεί διόγκωση των κυττάρων.
- Ισοτονικότητα είναι η παρουσία ενός διαλύματος που δεν προκαλεί αλλαγή στον όγκο των κυττάρων.
Όταν ένα βιολογικό κύτταρο βρίσκεται σε ένα υποτονικό περιβάλλον, το εσωτερικό του κυττάρου συσσωρεύει νερό, το νερό ρέει κατά μήκος της κυτταρικής μεμβράνης μέσα στο κύτταρο, προκαλώντας τη διαστολή του. Στα φυτικά κύτταρα, το κυτταρικό τοίχωμα περιορίζει την επέκταση, με αποτέλεσμα την πίεση στο κυτταρικό τοίχωμα από μέσα που ονομάζεται πίεση σπαργής (turgor pressure). Η πίεση σπαργής επιτρέπει στις πόες να στέκονται όρθιες. Είναι επίσης ο καθοριστικός παράγοντας για το πώς τα φυτά ρυθμίζουν το άνοιγμα των στομάτων τους. Στα ζωικά κύτταρα η υπερβολική ωσμωτική πίεση μπορεί να οδηγήσει σε κυτταρόλυση (cytolysis) λόγω της απουσίας κυτταρικού τοιχώματος. Η ωσμωτική πίεση είναι η βάση του φιλτραρίσματος ("αντίστροφη ώσμωση"), μια διαδικασία που χρησιμοποιείται συνήθως στον καθαρισμό του νερού. Το νερό που πρόκειται να καθαριστεί τοποθετείται σε ένα θάλαμο και τίθεται υπό πίεση μεγαλύτερη από την ωσμωτική πίεση που ασκείται από το νερό και τις διαλυμένες σε αυτό διαλυμένες ουσίες. Μέρος του θαλάμου ανοίγει σε μια διαφορικά διαπερατή μεμβράνη που αφήνει τα μόρια του νερού να περάσουν, αλλά όχι τα σωματίδια της διαλυμένης ουσίας. Η ωσμωτική πίεση του νερού των ωκεανών είναι περίπου 27 atm. Η αντίστροφη ώσμωση αφαλατώνει το γλυκό νερό από το αλμυρό νερό των ωκεανών και εφαρμόζεται παγκοσμίως σε πολύ μεγάλη κλίμακα.
Remove ads
Παραγωγή του τύπου Βαν'τ Χοφ
Θεωρήστε το σύστημα στο σημείο που έχει φτάσει σε ισορροπία. Η προϋπόθεση για αυτό είναι ότι το χημικό δυναμικό του διαλύτη (αφού μόνο αυτός είναι ελεύθερος να ρέει προς την ισορροπία) και στις δύο πλευρές της μεμβράνης είναι ίσο. Το διαμέρισμα που περιέχει τον καθαρό διαλύτη έχει χημικό δυναμικό , όπου είναι η πίεση. Από την άλλη πλευρά, στο διαμέρισμα που περιέχει τη διαλυμένη ουσία, το χημικό δυναμικό του διαλύτη εξαρτάται από το γραμμομοριακό κλάσμα του διαλύτη, . Επιπλέον, αυτό το διαμέρισμα μπορεί να υποτεθεί με διαφορετική πίεση, . Μπορούμε επομένως να γράψουμε το χημικό δυναμικό του διαλύτη ως . Αν γράψουμε , η ισορροπία του χημικού δυναμικού είναι επομένως:
Εδώ, η διαφορά πίεσης των δύο διαμερισμάτων ορίζεται ως η ωσμωτική πίεση που ασκείται από τις διαλυμένες ουσίες. Διατηρώντας την πίεση, η προσθήκη διαλυμένης ουσίας μειώνει το χημικό δυναμικό (ένα εντροπικό φαινόμενο). Έτσι, η πίεση του διαλύματος πρέπει να αυξηθεί σε μια προσπάθεια να αντισταθμιστεί η απώλεια του χημικού δυναμικού. Για να βρούμε το , την ωσμωτική πίεση, θεωρούμε την ισορροπία μεταξύ ενός διαλύματος που περιέχει διαλυμένη ουσία και καθαρό νερό.
Μπορούμε να γράψουμε την αριστερή πλευρά ως:
- ,
όπου είναι ο συντελεστής ενεργότητας του διαλύτη. Το προϊόν είναι επίσης γνωστό ως η ενεργότητα του διαλύτη, που για το νερό είναι η ενεργότητα του νερού . Η προσθήκη στην πίεση εκφράζεται μέσω της έκφρασης για την ενέργεια διαστολής:
όπου είναι ο γραμμομοριακός όγκος (m³/mol). Η εισαγωγή της έκφρασης που παρουσιάζεται παραπάνω στην εξίσωση χημικού δυναμικού για ολόκληρο το σύστημα και η αναδιάταξη θα καταλήξει σε:
Εάν το υγρό είναι ασυμπίεστο, ο μοριακός όγκος είναι σταθερός, και το ολοκλήρωμα γίνεται . Έτσι, παίρνουμε
Ο συντελεστής ενεργότητας είναι συνάρτηση της συγκέντρωσης και της θερμοκρασίας, αλλά στην περίπτωση αραιωμένων μειγμάτων, είναι συχνά πολύ κοντά στο 1,0, έτσι
Το γραμμομοριακό κλάσμα της διαλυμένης ουσίας, , είναι , επομένως το μπορεί να αντικατασταθεί με , το οποίο, όταν το είναι μικρό, μπορεί να προσεγγιστεί με .
Το γραμμομοριακό κλάσμα είναι . Όταν το είναι μικρό, μπορεί να προσεγγιστεί κατά . Επίσης, ο γραμμομοριακός όγκος μπορεί να γραφτεί ως όγκος ανά mol, . Ο συνδυασμός αυτών δίνει το εξής.
Για υδατικά διαλύματα αλάτων πρέπει να λαμβάνεται υπόψη ο ιονισμός. Για παράδειγμα, 1 mole NaCl ιονίζεται σε 2 mole ιόντων.
Remove ads
Παραπομπές
Εξωτερικοί σύνδεσμοι
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads



































