Ταχύτητα αντίδρασης
για ένα αντιδρόν ή προϊόν σε μια συγκεκριμένη αντίδραση ορίζεται διαισθητικά ως το πόσο γρήγορα ή αργά λαμβάνει χώρα μια αντίδραση From Wikipedia, the free encyclopedia
Η ταχύτητα αντίδρασης ή ρυθμός αντίδρασης (reaction rate ή rate of reaction) είναι η ταχύτητα με την οποία λαμβάνει χώρα μια χημική αντίδραση, η οποία ορίζεται ως ανάλογη της αύξησης της συγκέντρωσης ενός προϊόντος ανά μονάδα χρόνου και της μείωσης στη συγκέντρωση ενός αντιδρώντος ανά μονάδα χρόνου.[1] Οι ταχύτητες της αντίδρασης μπορεί να ποικίλλουν δραματικά. Για παράδειγμα, η οξειδωτική σκουριά του σιδήρου στην ατμόσφαιρα της Γης είναι μια αργή αντίδραση που μπορεί να διαρκέσει πολλά χρόνια, αλλά η καύση της κυτταρίνης σε μια φωτιά είναι μια αντίδραση που λαμβάνει χώρα σε κλάσματα του δευτερολέπτου. Για τις περισσότερες αντιδράσεις, ο ρυθμός μειώνεται καθώς προχωρά η αντίδραση. Η ταχύτητα μιας αντίδρασης μπορεί να προσδιοριστεί μετρώντας τις αλλαγές στη συγκέντρωση με την πάροδο του χρόνου. Η χημική κινητική είναι το μέρος της φυσικοχημείας που αφορά τον τρόπο με τον οποίο μετρώνται και προβλέπονται οι ταχύτητες των χημικών αντιδράσεων και πώς τα δεδομένα της ταχύτητας της αντίδρασης μπορούν να χρησιμοποιηθούν για την εξαγωγή πιθανών μηχανισμών της αντίδρασης.[2] Οι έννοιες της χημικής κινητικής εφαρμόζονται σε πολλούς κλάδους, όπως η χημική μηχανική,[3][4] η ενζυμολογία και η Μηχανική Περιβάλλοντος..[5][6][7]
| Ταχύτητα αντίδρασης | |
|---|---|
Συνήθη σύμβολα | ν |
| Μονάδα SI | mol⋅L-1⋅s-1 |
| Σε θεμελιώδεις μονάδες SI | mol⋅m-3⋅s-1 |
| Διαστάσεις | L-3⋅T-1⋅N |


Τυπικός ορισμός
Θεωρήστε μια τυπική χημική αντίδραση σε ισορροπία:
Τα πεζά γράμματα (a, b, p και q) αντιπροσωπεύουν τους στοιχειομετρικούς συντελεστές, ενώ τα κεφαλαία γράμματα αντιπροσωπεύουν τα αντιδρώντα (A και Bth και τα προϊόντα (P and Q). Σύμφωνα με τον ορισμό του Gold Book της IUPAC[8] the reaction rate η ταχύτητα της αντίδρασης για μια χημική αντίδραση που λαμβάνει χώρα σε ένα κλειστό σύστημα με σταθερό όγκο, χωρίς συσσώρευση ενδιάμεσων αντιδράσεων, ορίζεται ως: υποδηλώνει τη συγκέντρωση της ουσίας X (= A, B, P ή Q). Η ταχύτητα της αντίδρασης που ορίζεται έτσι έχει τις μονάδες mol/L/s. The IUPAC Η ταχύτητα μιας αντίδρασης είναι πάντα θετική. Υπάρχει ένα αρνητικό πρόσημο που δείχνει ότι η συγκέντρωση του αντιδρώντος μειώνεται. Η IUPAC [8] συνιστά η μονάδα χρόνου να είναι πάντα η δεύτερη. Η ταχύτητα αντίδρασης διαφέρει από την ταχύτητα αύξησης της συγκέντρωσης ενός προϊόντος P κατά σταθερό παράγοντα (το αντίστροφο του στοιχειομετρικού του αριθμού) και για ένα αντιδρών Α μείον το αντίστροφο του στοιχειομετρικού αριθμού. Οι στοιχειομετρικοί αριθμοί περιλαμβάνονται έτσι ώστε η καθορισμένη ταχύτητα να είναι ανεξάρτητη από το είδος του αντιδρώντος ή του προϊόντος που επιλέγεται για μέτρηση.[9]:349 Παραδείγματος χάρη, εάν a = 1 και b = 3, τότε το B καταναλώνεται τρεις φορές πιο γρήγορα από το A, αλλά ορίζεται μοναδικά. Ένα πρόσθετο πλεονέκτημα αυτού του ορισμού είναι ότι για μια στοιχειώδη και μη αμφίδρομη αντίδραση, το είναι ίσο με το γινόμενο της πιθανότητας υπέρβασης της ενέργειας ενεργοποίησης της μεταβατικής κατάστασης και ο αριθμός των φορών ανά δευτερόλεπτο που προσεγγίζεται η μεταβατική κατάσταση από τα αντιδρώντα μόρια. Όταν ορίζεται έτσι, για μια στοιχειώδη και μη αμφίδρομη αντίδραση, το είναι η ταχύτητα επιτυχών γεγονότων χημικής αντίδρασης που οδηγούν στο προϊόν. Ο παραπάνω ορισμός ισχύει μόνο για μια "μονή αντίδραση", σε "κλειστό σύστημα" "σταθερού όγκου". Εάν προστεθεί νερό σε μια κατσαρόλα που περιέχει αλμυρό νερό, η συγκέντρωση του αλατιού μειώνεται, αν και δεν υπάρχει χημική αντίδραση. Για ένα ανοιχτό σύστημα, το πλήρες ισοζύγιο μάζας πρέπει να λαμβάνεται υπόψη: όπου
- FA0 είναι ο ρυθμός εισροής του A σε μόρια ανά δευτερόλεπτο'
- FA η εκροή.
- είναι ο στιγμιαίος ρυθμός αντίδρασης του A (σε αριθμητική συγκέντρωση αντί για μοριακή) σε έναν δεδομένο διαφορικό όγκο, ενσωματωμένο σε ολόκληρο τον όγκο του συστήματος V σε μια δεδομένη στιγμή.
Όταν εφαρμόζεται στο κλειστό σύστημα σε σταθερό όγκο που εξετάστηκε προηγουμένως, αυτή η εξίσωση ανάγεται σε: , where όπου η συγκέντρωση [A] σχετίζεται με τον αριθμό των μορίων NA κατά Εδώ N0 είναι η σταθερά Αβογκάντρο. Για μια μεμονωμένη αντίδραση σε ένα κλειστό σύστημα ποικίλου όγκου, μπορεί να χρησιμοποιηθεί ο λεγόμενος ρυθμός μετατροπής προκειμένου να αποφευχθεί ο χειρισμός συγκεντρώσεων. Ορίζεται ως η παράγωγος της έκτασης της αντίδρασης (extent of reaction) σε σχέση με τον χρόνο. Εδώ νi είναι ο στοιχειομετρικός συντελεστής για την ουσία i, ίσος με a, b, p και q στην παραπάνω τυπική αντίδραση. Επίσης V είναι ο όγκος της αντίδρασης και Ci είναι η συγκέντρωση της ουσίας i. Όταν σχηματίζονται παραπροϊόντα ή ενδιάμεσα αντίδρασης, η IUPAC[8] συνιστά τη χρήση των όρων ρυθμός αύξησης της συγκέντρωσης και ρυθμός μείωσης της συγκέντρωσης για προϊόντα και αντιδρώντα, κατάλληλα. Οι ρυθμοί αντίδρασης μπορούν επίσης να οριστούν σε βάση που δεν είναι ο όγκος του αντιδραστήρα. Όταν χρησιμοποιείται ένας καταλύτης ο ρυθμός αντίδρασης μπορεί να δηλωθεί με βάση το βάρος του καταλύτη (mol g−1 s−1) ή την βάση του εμβαδού της επιφάνειας (mol m−2 s−1). Εάν η βάση είναι μια συγκεκριμένη θέση καταλύτη που μπορεί να μετρηθεί αυστηρά με μια καθορισμένη μέθοδο, ο ρυθμός δίνεται σε μονάδες s−1 και ονομάζεται συχνότητα αναπλήρωσης (turnover frequency).
Παράγοντες που επηρεάζουν
Παράγοντες που επηρεάζουν τον ρυθμό αντίδρασης είναι η φύση της αντίδρασης, η συγκέντρωση, η πίεση, η τάξη της αντίδρασης, η θερμοκρασία, ο διαλύτης, η ηλεκτρομαγνητική ακτινοβολία, ο καταλύτης, τα ισότοπα, το εμβαδόν της επιφάνεια, η ανάδευση και το όριο διάχυσης. Ορισμένες αντιδράσεις είναι φυσικά πιο γρήγορες από άλλες. Ο αριθμός των ειδών που αντιδρούν, η φυσική κατάστασή τους (τα σωματίδια που σχηματίζουν τα στερεά κινούνται πολύ πιο αργά από αυτά των αερίων ή εκείνα στο διάλυμα), η πολυπλοκότητα της αντίδρασης και άλλοι παράγοντες μπορούν να επηρεάσουν πολύ τον ρυθμό μιας αντίδρασης. H ταχύτητα αντίδρασης αυξάνεται με τη συγκέντρωση, όπως περιγράφεται από τον νόμο της ταχύτητας και εξηγείται από τη θεωρία των συγκρούσεων (collision theory). Καθώς η συγκέντρωση του αντιδρώντος αυξάνεται, αυξάνεται και η συχνότητα των συγκρούσεων. Ο ρυθμός των αέριων αντιδράσεων αυξάνεται με την πίεση, η οποία, στην πραγματικότητα, ισοδυναμεί με αύξηση της συγκέντρωσης του αερίου. Η ταχύτητα αντίδρασης αυξάνεται προς την κατεύθυνση όπου υπάρχουν λιγότερα mol αερίου και μειώνεται προς την αντίστροφη κατεύθυνση. Για αντιδράσεις συμπυκνωμένης φάσης, η εξάρτηση από την πίεση είναι ασθενής. Η τάξη της αντίδρασης ελέγχει τον τρόπο με τον οποίο η συγκέντρωση (ή η πίεση) του αντιδρώντος επηρεάζει την ταχύτητα της αντίδρασης. Συνήθως η διεξαγωγή μιας αντίδρασης σε υψηλότερη θερμοκρασία παρέχει περισσότερη ενέργεια στο σύστημα και αυξάνει την ταχύτητα αντίδρασης προκαλώντας περισσότερες συγκρούσεις μεταξύ των σωματιδίων, όπως εξηγείται από τη θεωρία των συγκρούσεων. Ωστόσο, ο κύριος λόγος που η θερμοκρασία αυξάνει την ταχύτητα αντίδρασης είναι ότι περισσότερα από τα συγκρουόμενα σωματίδια θα έχουν την απαραίτητη ενέργεια ενεργοποίησης με αποτέλεσμα πιο επιτυχημένες συγκρούσεις (όταν σχηματίζονται δεσμοί μεταξύ των αντιδρώντων). Η επίδραση της θερμοκρασίας περιγράφεται από την εξίσωση Arrhenius. Παραδείγματος χάρη, ο άνθρακας καίγεται σε ένα τζάκι παρουσία οξυγόνου, αλλά δεν καίγεται όταν αποθηκεύεται σε θερμοκρασία δωματίου. Η αντίδραση είναι αυθόρμητη σε χαμηλές και υψηλές θερμοκρασίες, αλλά σε θερμοκρασία δωματίου, η ταχύτητα της είναι τόσο αργή που είναι αμελητέα. Η αύξηση της θερμοκρασίας, όπως δημιουργείται από ένα σπίρτο, επιτρέπει στην αντίδραση να ξεκινήσει και στη συνέχεια θερμαίνεται η ίδια γιατί είναι εξώθερμη. Αυτό ισχύει για πολλά άλλα καύσιμα, όπως μεθάνιο, βουτάνιο και υδρογόνο. Οι ταχύτητες αντίδρασης μπορεί να είναι ανεξάρτητες από τη θερμοκρασία (μη-Αρένιους), ή να μειώνονται με την αύξηση της θερμοκρασίας (αντι-Αρένιους). Αντιδράσεις χωρίς φράγμα ενεργοποίησης (για παράδειγμα, ορισμένες ριζικές αντιδράσεις) τείνουν να έχουν εξάρτηση από τη θερμοκρασία αντι-Αρένιους: η σταθερά ταχύτητας μειώνεται με την αύξηση της θερμοκρασίας. Πολλές αντιδράσεις λαμβάνουν χώρα σε διάλυμα και οι ιδιότητες του διαλύτη επηρεάζουν την ταχύτητα αντίδρασης. Η ιονική ισχύς (ionic strength) έχει επίσης επίδραση στην ταχύτητα αντίδρασης. Η ηλεκτρομαγνητική ακτινοβολία είναι μια μορφή ενέργειας. Ως εκ τούτου, μπορεί να επιταχύνει την ταχύτητα ή ακόμη και να κάνει μια αντίδραση αυθόρμητη καθώς παρέχει στα σωματίδια των αντιδρώντων περισσότερη ενέργεια. Αυτή η ενέργεια με τον ένα ή τον άλλο τρόπο αποθηκεύεται στα αντιδρώντα σωματίδια (μπορεί να σπάσει δεσμούς και να προωθήσει τα μόρια σε ηλεκτρονικά ή δονητικά διεγερμένες καταστάσεις...) δημιουργώντας ενδιάμεσα είδη που αντιδρούν εύκολα. Καθώς η ένταση του φωτός αυξάνεται, τα σωματίδια απορροφούν περισσότερη ενέργεια και ως εκ τούτου η ταχύτητα αντίδρασης αυξάνεται. Παραδείγματος χάρη, όταν το μεθάνιο αντιδρά με το χλώριο στο σκοτάδι, η ταχύτητα αντίδρασης είναι αργή. Μπορεί να επιταχυνθεί όταν το μείγμα τεθεί υπό διάχυτο φως. Σε έντονο ηλιακό φως, η αντίδραση είναι εκρηκτική. Η παρουσία ενός καταλύτη αυξάνει την ταχύτητα αντίδρασης (και στις δύο κατευθύνσεις) παρέχοντας μια εναλλακτική οδό με χαμηλότερη ενέργεια ενεργοποίησης. Παραδείγματος χάρη, ο λευκόχρυσος καταλύει την καύση υδρογόνου με οξυγόνο σε θερμοκρασία δωματίου. Το φαινόμενο του κινητικού ισοτόπου συνίσταται σε διαφορετική ταχύτητα αντίδρασης για το ίδιο μόριο εάν έχει διαφορετικά ισότοπα, συνήθως ισότοπα υδρογόνου, λόγω της σχετικής διαφοράς μάζας μεταξύ υδρογόνου και δευτερίου. Σε επιφανειακές αντιδράσεις, οι οποίες λαμβάνουν χώρα, παραδείγματος χάρη, κατά τη διάρκεια ετερογενούς κατάλυσης, η ταχύτητα αντίδρασης αυξάνεται όσο αυξάνεται η επιφάνεια. Αυτό συμβαίνει επειδή περισσότερα σωματίδια του στερεού εκτίθενται και μπορούν να χτυπηθούν από μόρια αντιδρώντων. Η ανάδευση μπορεί να έχει ισχυρή επίδραση στην ταχύτητα αντίδρασης για ετερογενείς αντιδράσεις. Ορισμένες αντιδράσεις περιορίζονται από τη διάχυση. Όλοι οι παράγοντες που επηρεάζουν την ταχύτητα αντίδρασης, εκτός από τη συγκέντρωση και την τάξη της αντίδρασης, λαμβάνονται υπόψη στον συντελεστή ταχύτητας της αντίδρασης (ο συντελεστής στην εξίσωση ταχύτητας της αντίδρασης).
Εξίσωση ταχύτητας
Για μια χημική αντίδραση aA + bB → pP + qQ, η εξίσωση ρυθμού ή νόμος ταχύτητας είναι μια μαθηματική έκφραση που χρησιμοποιείται στη χημική κινητική για να συνδέσει την ταχύτητα (ρυθμό) μιας αντίδρασης με τη συγκέντρωση κάθε αντιδρώντος. Για ένα κλειστό σύστημα με σταθερό όγκο, αυτό είναι συχνά της μορφής Για αντιδράσεις που ολοκληρώνονται (που συνεπάγεται πολύ μικρό kr), ή εάν αναλύεται μόνο ο αρχικός ρυθμός (με αρχικές συγκεντρώσεις προϊόντος που εξαφανίζονται), αυτό απλοποιείται στη φόρμα που αναφέρεται συνήθως Για την αντίδραση αέριας φάσης η εξίσωση ρυθμού εκφράζεται συχνά εναλλακτικά με όρους μερικών πιέσεων. Σε αυτές τις εξισώσεις k(T) είναι ο συντελεστής ταχύτητας αντίδρασης ή σταθερά ταχύτητας, αν και στην πραγματικότητα δεν είναι σταθερά, γιατί περιλαμβάνει όλες τις παραμέτρους που επηρεάζουν την ταχύτητα αντίδρασης, εκτός από τον χρόνο και τη συγκέντρωση. Από όλες τις παραμέτρους που επηρεάζουν τις ταχύτητες αντίδρασης, η θερμοκρασία είναι συνήθως η πιο σημαντική και λαμβάνεται υπόψη από την εξίσωση Αρένιους. Οι εκθέτες n και m ονομάζονται τάξεις αντίδρασης και εξαρτώνται από τον μηχανισμό της αντίδρασης. Για μια στοιχειώδη (ενός σταδίου) αντίδραση, η τάξη σε σχέση με κάθε αντιδρών είναι ίση με τον στοιχειομετρικό του συντελεστή. Ωστόσο, για πολύπλοκες (πολλών σταδίων) αντιδράσεις, αυτό συχνά δεν είναι αλήθεια και η εξίσωση του ρυθμού καθορίζεται από τον λεπτομερή μηχανισμό, όπως φαίνεται παρακάτω για την αντίδραση των H2 και NO. Για στοιχειώδεις αντιδράσεις ή στάδια αντίδρασης, η τάξη και ο στοιχειομετρικός συντελεστής είναι και οι δύο ίσοι με τη μοριακότητα (molecularity) ή τον αριθμό των μορίων που συμμετέχουν σε αυτές. Για μια μονομοριακή αντίδραση ή βήμα, η ταχύτητα (ρυθμός) είναι ανάλογη με τη συγκέντρωση των μορίων του αντιδρώντος, επομένως ο νόμος της ταχύτητας είναι πρώτης τάξης. Για μια διμοριακή αντίδραση ή βήμα, ο αριθμός των συγκρούσεων είναι ανάλογος με το γινόμενο των δύο συγκεντρώσεων των αντιδρώντων, ή δεύτερης τάξης. Ένα τριμοριακό βήμα προβλέπεται να είναι τρίτης τάξης, αλλά είναι και πολύ αργό καθώς οι ταυτόχρονες συγκρούσεις τριών μορίων είναι σπάνιες. Χρησιμοποιώντας το ισοζύγιο μάζας για το σύστημα στο οποίο λαμβάνει χώρα η αντίδραση, μπορεί να προκύψει μια έκφραση για το ρυθμό μεταβολής της συγκέντρωσης. Για ένα κλειστό σύστημα με σταθερό όγκο, μια τέτοια έκφραση μπορεί να μοιάζει με
Παράδειγμα σύνθετης αντίδρασης: υδρογόνο και μονοξείδιο του αζώτου
Για την αντίδραση η εξίσωση της παρατηρούμενης ταχύτητας (ή η έκφραση της ταχύτητας) είναι Όπως για πολλές αντιδράσεις, η πειραματική εξίσωση ταχύτητας δεν αντικατοπτρίζει απλώς τους στοιχειομετρικούς συντελεστές στη συνολική αντίδραση: Είναι τρίτης τάξης συνολικά: πρώτης τάξης στο H2 και δεύτερης τάξης στο ΝΟ, παρόλο που οι στοιχειομετρικοί συντελεστές και των δύο αντιδρώντων είναι ίσοι με 2.[10] Στη χημική κινητική, η συνολική ταχύτητα της αντίδρασης εξηγείται συχνά χρησιμοποιώντας έναν μηχανισμό που αποτελείται από έναν αριθμό στοιχειωδών βημάτων. Δεν επηρεάζουν όλα αυτά τα βήματα την ταχύτητα της αντίδρασης. Κανονικά το πιο αργό στοιχειώδες βήμα ελέγχει την ταχύτητα της αντίδρασης. Για αυτό το παράδειγμα, ένας πιθανός μηχανισμός είναι Οι αντιδράσεις 1 και 3 είναι πολύ γρήγορες σε σύγκριση με τη δεύτερη, επομένως η αργή αντίδραση 2 είναι το βήμα καθορισμού της ταχύτητας. Αυτή είναι μια διμοριακή στοιχειώδης αντίδραση της οποίας ο ρυθμός δίνεται από την εξίσωση δεύτερης τάξης όπου k2 είναι η σταθερά ταχύτητας για το δεύτερο βήμα. Ωστόσο, το N2O2 είναι ένα ασταθές ενδιάμεσο του οποίου η συγκέντρωση προσδιορίζεται από το γεγονός ότι το πρώτο βήμα βρίσκεται σε ισορροπία, έτσι ώστε όπου K1 είναι η σταθερά ισορροπίας του πρώτου βήματος. Η αντικατάσταση αυτής της εξίσωσης στην προηγούμενη εξίσωση οδηγεί σε μια εξίσωση ταχύτητας που εκφράζεται με όρους των αρχικών αντιδρώντων Αυτό συμφωνεί με τη μορφή της εξίσωσης της παρατηρούμενης ταχύτητας εάν υποτεθεί ότι k = k2K1. Στην πράξη, η εξίσωση ταχύτητας χρησιμοποιείται για να προτείνει πιθανούς μηχανισμούς που προβλέπουν μια εξίσωση ταχύτητας σε συμφωνία με το πείραμα. Το δεύτερο μόριο του H2 δεν εμφανίζεται στην εξίσωση ταχύτητας επειδή αντιδρά στο τρίτο βήμα, το οποίο είναι ένα γρήγορο βήμα μετά το στάδιο προσδιορισμού της ταχύτητας, έτσι ώστε να μην επηρεάζει τη συνολική ταχύτητα της αντίδρασης.
Εξάρτηση από τη θερμοκρασία
Κάθε συντελεστής ταχύτητας αντίδρασης k έχει μια εξάρτηση από τη θερμοκρασία, η οποία συνήθως δίνεται από την εξίσωση Αρένιους: όπου
- A, είναι ο προεκθετικός παράγοντας ή συντελεστής συχνότητας,
- exp είναι η εκθετική συνάρτηση,
- Ea είναι η ενέργεια ενεργοποίησης,
- R είναι η παγκόσμια σταθερά των αερίων.
Δεδομένου ότι στη θερμοκρασία T τα μόρια έχουν ενέργειες που δίνονται από μια κατανομή Boltzmann, μπορεί κανείς να περιμένει τον αριθμό των συγκρούσεων με ενέργεια μεγαλύτερη από Ea. να είναι ανάλογη του Οι τιμές για A και Ea εξαρτώνται από την αντίδραση. Υπάρχουν επίσης δυνατές πιο σύνθετες εξισώσεις που περιγράφουν την εξάρτηση από τη θερμοκρασία άλλων σταθερών ταχύτητας που δεν ακολουθούν αυτό το πρότυπο. Η θερμοκρασία είναι ένα μέτρο της μέσης κινητικής ενέργειας των αντιδρώντων. Καθώς η θερμοκρασία αυξάνεται, η κινητική ενέργεια των αντιδρώντων αυξάνεται. Δηλαδή τα σωματίδια κινούνται πιο γρήγορα. Με τα αντιδρώντα να κινούνται γρηγορότερα, αυτό επιτρέπει να λαμβάνουν χώρα περισσότερες συγκρούσεις με μεγαλύτερη ταχύτητα, έτσι η πιθανότητα τα αντιδρώντα να σχηματίζουν προϊόντα αυξάνεται, γεγονός που με τη σειρά του οδηγεί στην αύξηση της ταχύτητας αντίδρασης. Μια άνοδος δέκα βαθμών Κελσίου οδηγεί σε περίπου διπλάσια ταχύτητα αντίδρασης.
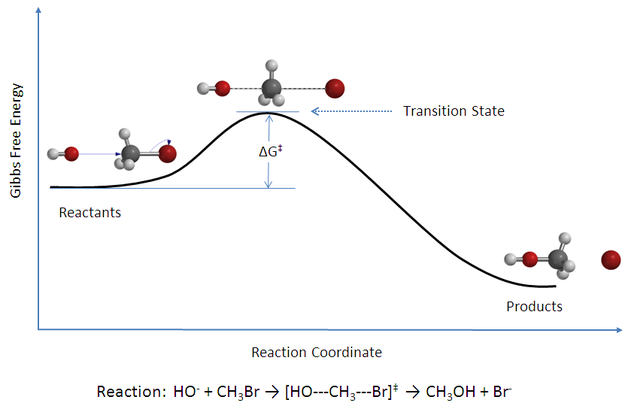
Η ελάχιστη κινητική ενέργεια που απαιτείται για να συμβεί μια αντίδραση ονομάζεται ενέργεια ενεργοποίησης και συμβολίζεται με Ea ή ΔG‡. Η κατάσταση μετάβασης ή το ενεργοποιημένο σύμπλοκο που φαίνεται στο διάγραμμα είναι το ενεργειακό φράγμα που πρέπει να ξεπεραστεί όταν μετατρέπονται τα αντιδρώντα σε προϊόντα. Τα μόρια με ενέργεια μεγαλύτερη από αυτό το φράγμα έχουν αρκετή ενέργεια για να αντιδράσουν. Για να πραγματοποιηθεί μια επιτυχής σύγκρουση, η γεωμετρία της σύγκρουσης πρέπει να είναι σωστή, που σημαίνει ότι τα μόρια των αντιδραστηρίων πρέπει να κοιτούν με τον σωστό τρόπο, ώστε να μπορεί να σχηματιστεί το ενεργοποιημένο σύμπλοκο. Μια χημική αντίδραση λαμβάνει χώρα μόνο όταν τα σωματίδια που αντιδρούν συγκρούονται. Ωστόσο, δεν είναι όλες οι συγκρούσεις αποτελεσματικές για την πρόκληση της αντίδρασης. Τα προϊόντα σχηματίζονται μόνο όταν τα συγκρουόμενα σωματίδια διαθέτουν μια ορισμένη ελάχιστη ενέργεια που ονομάζεται ενέργεια κατωφλίου. Κατά κανόνα, οι ρυθμοί αντίδρασης για πολλές αντιδράσεις διπλασιάζονται για αύξηση της θερμοκρασίας κάθε δέκα βαθμούς Κελσίου.[11] Για μια δεδομένη αντίδραση, η αναλογία της σταθεράς ταχύτητας της σε υψηλότερη θερμοκρασία προς τη σταθερά της ταχύτητας της σε χαμηλότερη θερμοκρασία είναι γνωστή ως συντελεστής θερμοκρασίας της (temperature coefficient), (Q). Το Q10 χρησιμοποιείται συνήθως ως ο λόγος των σταθερών ταχύτητας που απέχουν δέκα βαθμούς Κελσίου.
Εξάρτηση από την πίεση
Η εξάρτηση από την πίεση της σταθεράς ταχύτητας για αντιδράσεις συμπυκνωμένης φάσης (δηλαδή, όταν τα αντιδρώντα και τα προϊόντα είναι στερεά ή υγρά) είναι συνήθως αρκετά ασθενής στο εύρος των πιέσεων που κανονικά συναντώνται στη βιομηχανία και παραλείπεται στην πράξη. Η εξάρτηση από την πίεση της σταθεράς ταχύτητας σχετίζεται με τον όγκο ενεργοποίησης. Για την αντίδραση που εξελίσσεται μέσω ενός συμπλόκου κατάστασης ενεργοποίησης: ο όγκος ενεργοποίησης, ΔV ‡, είναι: όπου το V̄ υποδηλώνει τον μερικό μοριακό όγκο (partial molar volume) ενός είδους και ο ‡ (διπλός σταυρός) δηλώνει το σύμπλοκο της κατάστασης ενεργοποίησης. Για την παραπάνω αντίδραση, μπορεί κανείς να αναμένει ότι η μεταβολή της σταθεράς της ταχύτητας αντίδρασης (με βάση είτε το γραμμομοριακό κλάσμα είτε τη γραμμομοριακότητα κατ΄ όγκο) με πίεση σε σταθερή θερμοκρασία είναι:[9]:390
Στην πράξη, το θέμα μπορεί να είναι πολύπλοκο επειδή οι μερικοί μοριακοί όγκοι και ο όγκος ενεργοποίησης μπορεί οι ίδιοι να είναι συναρτήσεις της πίεσης. Οι αντιδράσεις μπορούν να αυξήσουν ή να μειώσουν τις ταχύτητές τους με την πίεση, ανάλογα με την τιμή του ΔV ‡. Ως παράδειγμα του πιθανού μεγέθους του φαινομένου της πίεσης, μερικές οργανικές αντιδράσεις αποδείχθηκε ότι διπλασιάζουν την ταχύτητα αντίδρασης όταν η πίεση αυξήθηκε από ατμοσφαιρική (0,1 MPa) σε 50 MPa (που δίνει ΔV ‡ = −0,025 L/mol). [12]
Σημειώσεις
Εξωτερικοί σύνδεσμοι
Wikiwand - on
Seamless Wikipedia browsing. On steroids.



![{\displaystyle \nu =-{\frac {1}{a}}{\frac {d[\mathrm {A} ]}{dt}}=-{\frac {1}{b}}{\frac {d[\mathrm {B} ]}{dt}}={\frac {1}{p}}{\frac {d[\mathrm {P} ]}{dt}}={\frac {1}{q}}{\frac {d[\mathrm {Q} ]}{dt}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/7b382dec84d49d40aafd6f0c9717bab5e58eaf9c)
![{\displaystyle \nu =-{\tfrac {d[\mathrm {A} ]}{dt}}=-{\tfrac {1}{3}}{\tfrac {d[\mathrm {B} ]}{dt}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/b2f5b4b2ab339783d5a1790c768782bd00d95c84)

![{\displaystyle \nu ={\frac {d[A]}{dt}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/73c02a18a36bb4f54961076ca9ebba7a305e79c8)
![{\displaystyle [\mathrm {A} ]={\tfrac {N_{\rm {A}}}{N_{0}V}}.}](http://wikimedia.org/api/rest_v1/media/math/render/svg/6303758f0571e003481db93d87bf5ea47fffd7b2)

![{\displaystyle v=k[\mathrm {A} ]^{n}[\mathrm {B} ]^{m}-k_{r}[\mathrm {P} ]^{i}[\mathrm {Q} ]^{j}.}](http://wikimedia.org/api/rest_v1/media/math/render/svg/bc9539e30d22fcbd3ecfc9f39be72109ac35d6ac)
![{\displaystyle v=k(T)[\mathrm {A} ]^{n}[\mathrm {B} ]^{m}.}](http://wikimedia.org/api/rest_v1/media/math/render/svg/c56f86858a4c9e8a968aca4535d3ef4536c4a9ca)
![{\displaystyle {\frac {d[\mathrm {P} ]}{dt}}=k(T)[\mathrm {A} ]^{n}[\mathrm {B} ]^{m}.}](http://wikimedia.org/api/rest_v1/media/math/render/svg/8e509689b334d89d2e9e85b86b5341997a3c504f)

![{\displaystyle v=k[{\ce {H2}}][{\ce {NO}}]^{2}.}](http://wikimedia.org/api/rest_v1/media/math/render/svg/355ef4e81a95c6d27d40c6220feb78245103bb0a)

![{\displaystyle v=k_{2}[{\ce {H2}}][{\ce {N2O2}}],}](http://wikimedia.org/api/rest_v1/media/math/render/svg/885399c11c8fe02979a9bcffd9ef8b2b1b72e468)
![{\displaystyle {\ce {[N2O2]={\mathit {K}}_{1}[NO]^{2}}},}](http://wikimedia.org/api/rest_v1/media/math/render/svg/509341ec6a7b3830ebbdb414dd8864d0360fce99)
![{\displaystyle v=k_{2}K_{1}[{\ce {H2}}][{\ce {NO}}]^{2}\,.}](http://wikimedia.org/api/rest_v1/media/math/render/svg/b264e9db264b7df4817dde20e11227f14c5ead59)




