Chlorate sind Salze der Chlorsäure HClO3. Sie enthalten als Anion das Chlorat-Ion (ClO3−).[1] Chlor weist dabei die Oxidationszahl +5 auf. Wichtige Chlorate sind Natriumchlorat, Aluminiumchlorat und Kaliumchlorat.
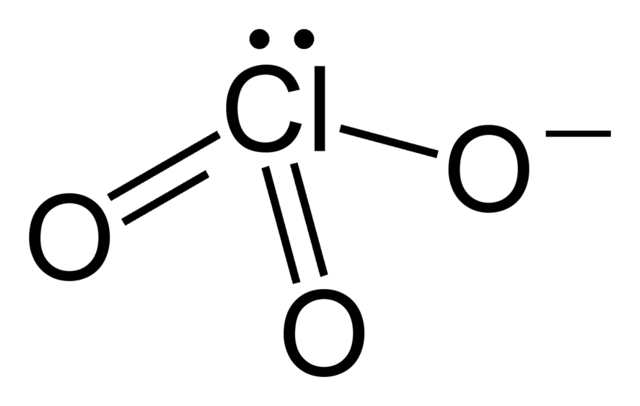

Die meisten Chlorate sind starke und spontan reagierende Oxidationsmittel. Gemische von Chloraten mit Reduktionsmitteln wurden früher auch als Explosivstoffe und Zündmittel (siehe Chloratsprengstoffe) verwendet. Heute werden sie hierzu wegen ihrer Reibungsempfindlichkeit und der Tendenz zur Spontanreaktion nicht mehr eingesetzt.[2]
Natrium- und Kaliumchlorat wurden in der Vergangenheit als Unkrautbekämpfungsmittel eingesetzt[3][4]. Die Rückstands-Höchstgehalte in Lebensmitteln/Erzeugnissen sind europaweit in der geänderten Verordnung (EG) Nr. 396/2005 geregelt[5].
Bindungsstruktur
Durch die Lewisschreibweise wird meist nur eine mesomere Grenzstruktur des Chlorat-Ions dargestellt. Tatsächlich sind alle Cl-O Bindungen identisch, was durch die gleiche Länge aller Bindungen zum Ausdruck kommt (für Kaliumchlorat beispielsweise 1,49 Å[6])
Siehe auch
Einzelnachweise
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.
