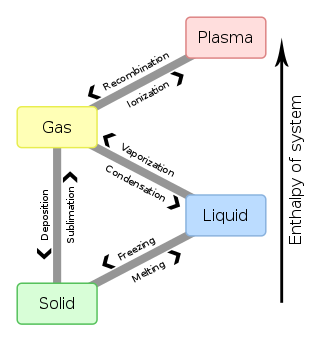
I fysikvidenskaberne er en fase eller stoffase tilstanden af det makroskopiske fysiske system, som har nogenlunde ens kemisk sammensætning og fysiske egenskaber (f.eks. massefylde, krystalstruktur, brydningsindeks...). De mest kendte faseeksempler (tidligere tilstandsformer) er:
 For alternative betydninger, se Fase. (Se også artikler, som begynder med Fase)
For alternative betydninger, se Fase. (Se også artikler, som begynder med Fase) Denne artikel bør gennemlæses af en person med fagkendskab for at sikre den faglige korrekthed.
Denne artikel bør gennemlæses af en person med fagkendskab for at sikre den faglige korrekthed.
Mindre kendte faser omfatter stoffers diamagnetiske, paramagnetiske og ferromagnetiske faser.
Her er en liste over nogle af de videnskabeligt anerkendte stoffaser:
- Plasma (ioniseret gas)
- Gasform, "luftformigt"
- Flydende form
- Superflydende fast stof[1][2][3][4][5]
- Fast form
- Bose-Einstein kondensat
- Fermionisk kondensat[6][7][8]
Her udover spekuleres der i yderligere tilstandsformer/faser:
- "polariton superfluid"[9]
- "Bosonmetal"[10]
- "Nukleonagtig stof" – En neutronstjernes massefylde antages at være tæt på atomkerners og neutroners.[11]
- "Kvarkagtig stof" – En kvarkstjernes massefylde antages at være højere end neutronstjerners og dermed atomkerners og neutroners.[11]
Definition
Selvom faser er begrebsmæssigt simple, er de svære at definere præcist. En god definition af et systems fase, er et område i parameterrummet af systemets termodynamiske variable, hvor den "frie" energi opfører sig matematisk analytisk.
Det kan også udtrykkes ved, at 2 forskellige tilstande af et system er samme fase, hvis de kan afbildes til hinanden uden hop eller knæk i enhver af deres termodynamiske egenskaber.
Når et system går fra en fase til en anden, vil der generelt være et hop eller knæk, hvor den frie energi er ikke-analytisk. Dette benævnes en faseovergang, faseskift. Almindelige kendte faseovergange er smeltning (fast til flydende) og fortætning (kondensation, gas til flydende). Grundet denne ikke-analytiske, vil den frie energi på begge sider af faseskiftet være 2 forskellige analytiske funktioner, så en eller flere termodynamiske egenskaber vil opføre sig meget anderledes efter faseskiftet.
Den mest undersøgte termodynamiske egenskab er varmekapacitet. Ved et faseskift vil varmekapacitetsgrafen enten gå mod uendelig, hoppe til en anden værdi eller knække (en af funktionens afledede vil være diskontinuert).

Mulige varmekapacitetsgrafer (C) som funktion af temperaturen (T) ved et faseskift.
Fasediagram
Et systems forskellige faser kan repræsenteres med et fasediagram. Diagrammets akser er de relevante termodynamiske variable. For simple mekaniske systemer anvendes hovedsageligt tryk og temperatur. Den følgende figur viser et fasediagram for et typisk stof som udviser en fast-, flydende- og gas-fase.
- Et typisk fasediagram
- Fasediagram for jern-jernkarbid (Fe-Fe3C. Procentdelen af kulstof (x-aksen) og temperaturen (y-aksen) definerer fasen for jernkarbid-legeringen og dermed dens fysiske og mekaniske egenskaber. Andelen af kulstof afgør typen af den jernholdige legering som enten jern, stål eller støbejern.
Anvendelse

En kendt formel, idealgasligningen, som gælder for en afspærret mængde af en ideel gas og tilnærmelsesvis også for molekylære gasser er:
P * V = n * R * T
Formlen gælder netop kun når stoffet er på gasform. Hvis noget af stoffet fortættes eller sublimerer, så gælder formlen ikke. Så længe formlens variable er strengt matematisk positive er formlen analytisk, lige meget hvilken variabel der isoleres.
Blandinger
Stofblandinger kan være homogene eller heterogene, eller i flere faser, f.eks. en blanding af olie og vand (se billedet).
Kilder/referencer
Se også
Eksterne henvisninger
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.