MHC glykoprotein I. třídy
From Wikipedia, the free encyclopedia
MHC glykoproteiny (gp) I. třídy jsou transmembránové molekuly, jejichž funkcí je prezentace antigenu CD8+ T-buňkám.
Úvod

MHC gp I. třídy se nacházejí na většině buněk organismu. Jejich funkcí je prezentovat antigenní peptidy z patogenů (nejčastěji virů) CD8+ cytotoxickým T – lymfocytům. Vzhledem k tomu, že viry mohou napadnout prakticky jakoukoliv jadernou buňku organismu (v bezjaderných buňkách se viry nedokáží replikovat), dochází k expresi MHC gp I. třídy na všech jaderných buňkách organismu (např. na červených krvinkách MHC gp I. třídy nejsou). Na povrchu jedné buňky lze nalézt řádově 104 MHC I molekul. Avšak úroveň konstitutivní exprese je různá u různých typů buněk.
MHC gp I. třídy vážou proteiny cytosolického původu. Mohou tedy vázat peptidy buňce vlastní, peptidy virového původu či peptidy původem z bakterií žijících v cytosolu. Buňce vlastní peptidy vystavené na MHC gp I. třídy nejsou antigenní (neaktivují T-buňky), neboť cytotoxické T-lymfocyty, které by mohly rozeznat komplexy MHC:vlastní peptid jsou v procesu udržování tolerance vůči vlastním tkáním eliminovány, inaktivovány nebo suprimovány regulačními T-buňkami.
Receptor na povrchu T – buněk (TCR) je specifický pro unikátní kombinaci peptidu a MHC molekuly. Jinými slovy T – buňky rozeznají jak peptid navázaný na MHC, tak MHC molekulu. Tento jev se nazývá MHC – restrikce.
MHC gp Ia jsou rozeznávány i NK buňkami. NK buňky však pomocí svých receptorů nerozeznávají všechny izotypy MHC molekul, popřípadě jednotlivé alely konkrétních izotypů, se stejnou účinností (viz dále).
MHC molekuly jsou přítomny u chrupavčitých ryb a u všech vyšších obratlovců. Nebyly nalezeny u bezčelistnatých ryb a bezobratlých.
Struktura MHC gp
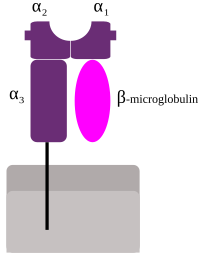
MHC gp I. třídy sestávají ze dvou polypeptidových řetězců:
- α – řetězec: molekulová hmotnost je 43–45 kDa; je tvořen 3 globulárními doménami
- β2 – mikroglobulin (β2-m): není polymorfní, je kódován mimo MHC – u lidí je lokalizován na 15. chromozomu, u myší na 2. chromozomu; molekulová hmotnost je 12 kDa
α – řetězec je kódován v MHC genové oblasti a je nekovalentně asociován s menším β2-m řetězcem. Pouze α – řetězec prochází membránou.
Kompletní molekula MHC gp I je složena ze 4 domén: α1, α2, α3 a β2-m domény. Domény α3 a β2-m strukturálně připomínají imunoglobulinové domény. α1 a α2 tvoří stěny žlábku vázajícího peptidy na povrchu molekuly MHC. Žlábek je lemován dvěma α – helixy a jeho dno je tvořeno osmi antiparalelními β řetězci.
MHC molekuly I. třídy (konkrétně doména α3 ) interagují s T-buněčným koreceptorem CD8.
Hlavní histokompatibilní komplex
MHC glykoproteiny I. třídy jsou kódovány v genové oblasti zvané MHC (Major Histocompatibility Complex; Hlavní histokompatibilní komplex). Lidé mají MHC lokalizován na 6. chromozomu, myši na chromozomu 17. Jedná se o oblast polygenní (=existuje několik různých izotypů MHC gp I. třídy) a polymorfní (=existuje mnoho variant/alel každého genu v populaci). Jedná se dokonce o nejpolymorfnější geny, které jsou známy. Pro geny HLA-A a HLA-B je již známo přes 1000 alel. Navíc je velmi pravděpodobné, že studie prováděné na populacích v Africe odhalí další varianty genů pro MHC gp I.
Vzhledem k vysokému polymorfismu patří většina lidí mezi heterozygoty pro MHC proteiny – to jest matky a od otce zdědili odlišné alely pro konkrétní MHC izotyp. Kombinace MHC alel na jednom chromozomu se nazývá MHC haplotyp.
Lidské MHC geny jsou nazývány HLA geny (Human leukocyte antigen), u myší jsou označovány jako H-2 geny. Exprese MHC genů je kodominantní – proteinový produkt obou alel v jednom lokusu (tedy pro jeden izotyp MHC gp I) je v jedné buňce exprimován ve stejném množství.
Proč jsou MHC geny tak polymorfní?
Rozdílné MHC varianty preferenčně vážou rozdílné peptidy. Peptidy, které se vážou na konkrétní MHC variantu mají stejné či velmi podobné aminokyselinové zbytky na 2–3 přesných pozicích v rámci své sekvence. Tyto aminokyselinové zbytky se nazývají „kotevní“ (anchor residues). Jak pozice, tak identita těchto zbytků je různá v závislosti na MHC variantě. Vazba peptidu do vazebné rýhy je ovlivněna přítomností i ostatních aminokyselinových zbytků, tzv. „sekundárních kotev“ (secondary anchors). Jinými slovy – přítomnost určitých aminokyselin v určitých pozicích je preferována či naopak může bránit vazbě peptidů na MHC. Tímto způsobem je zajištěno, že různé produkty alel pro MHC gp I třídy mohou vázat různé sady peptidů. Soubor kotevních zbytků, které umožňují vazbu k určité MHC I molekuly se nazývá „sekvenční motiv“ (sequence motif). Lze dokonce odhadnout strukturu peptidu, či proteinu, který by se na konkrétní variantu mohl vázat. Tohoto poznatku se využívá při přípravě vakcín.
Polymorfismus je zaznamenán hlavně v oblasti kódující aminokyseliny ležící ve vazebné rýze MHC molekuly. Proč právě tam? Vysvětlení se nejčastěji spojuje s evoluční biologií a „závodech ve zbrojení“ mezi patogenem a hostitelem. V evolučním čase se patogeny snaží změnit své antigeny, aby se vyhnuly asociaci s MHC proteiny. V případě, že se to nějakému patogenu podaří, dojde k epidemii. Pokud bude v populaci pár jedinců produkovat „nové“ MHC proteiny, které dokáží asociovat s novým antigenem, budou mít tito selekční výhodu. (Např. HLA-B53: v Západní Africe je až 25 % populace nositelem této alely, byť je v ostatních částech světa tato alela vzácná. Jedinci nesoucí tuto alelu jsou méně citliví k těžké formě malárie, která se v této části světa vyskytuje).
Na vzniku nových alel se podílejí především bodové mutace a genové konverze (=sekvence v jednom genu je částečně nahrazena sekvencí z jiného genu).
Na druhou stranu polygennost MHC molekul je omezená: T-buňky, které se svým TCR silně vážou na vlastní peptidy navázané na MHC molekule, musejí být na počátku svého vývoje eliminovány, aby se udržela tolerance vůči vlastním tkáním. Počet MHC je tedy pravděpodobně balancován mezi výhodou prezentace širokého spektra cizích peptidů a nevýhodou významného omezení repertoáru T-buněk během negativní selekce.
Transplantace a studie zaměřené na MHC
MHC gp jsou známy i pod pojmem transplantační antigeny. MHC byl v počátcích studován jako genetický komplex, který ovlivňuje schopnost organismu akceptovat či rejektovat transplantovanou tkáň z jiného organismu stejného druhu. Imunitní systém obecně toleruje vlastní MHC gp I v komplexu s vlastními peptidy, zatímco proti cizím MHC gp vzniká imunitní reakce. Pro transplantace se tudíž hledají dárci podle alel v MHC komplexu (celá problematika je poněkud komplikovanější; vyžadovaná shoda v MHC komplexu mezi dárcem a příjemcem závisí i na orgánu, který má být transplantován). Vysoký polymorfismus MHC gp I je příčinou obtížného hledání dárců pro některé typy tkáňových transplantací a to i mezi příbuznými jedinci: heterozygotičtí rodiče totiž mohou své haplotypy nakombinovat čtyřmi různými způsoby; jejich děti se tedy velmi pravděpodobně mezi sebou budou lišit v kombinaci MHC alel.
V současné době se studie MHC gp I zaměřují na spojitost mezi konkrétními alelami MHC gp I a rozvojem autoimunitních onemocnění, náchylností ke konkrétním infekcím apod.
Vazba peptidů na MHC gp
Vznik komplexu MHC:peptid
MHC molekuly jsou v průběhu syntézy transportovány do endoplazmatického retikula (ER). Až v lumen ER dojde ke správnému sbalení obou řetězců MHC molekuly a ke vzniku vazebného místa pro peptidy – vazebné místo tedy nikdy není nasměrováno do cytosolu. Správné „sbalení“ MHC molekuly je umožněno asociací α – řetězce, β2-m a peptidu.
Proteiny jsou v cytosolu degradovány proteazomem na krátké peptidy. Ty jsou pak do ER kontinuálně transportovány pomocí TAP transportérů TAP1 a TAP2 (transporters associated with antigen processing), které pocházejí z rodiny ABC transportérů (při transportu proteinů tedy dochází k hydrolýze ATP). TAP proteiny preferují přenos peptidů o velikosti 8–16 aminokyselin s hydrofobními nebo bazickými aminokyselinovými zbytky na C-konci. Na vzniku komplexu MHC:peptid se podílí řada dalších proteinů, tvořících tzv. Peptide-loading complex (PLC) – zejména tapasin, calreticulin, calnexin a ERp57[1].
Pouze v případě, že je na MHC molekulu navázán peptid, putuje celý komplex z ER na povrch buňky. MHC gp I. třídy jsou nestabilní, pokud na nich není navázán peptid. Vazba peptidu na molekulu MHC je stabilní ( Kd~10−6–10−10). Po disociaci peptidu a MHC gp I na povrchu buňky, změní MHC gp I svou konformaci, β2-m disociuje a α – řetězec je internalizován do buňky a rychle degradován.
MHC I deficience – syndrom holých lymfocytů (BLS) typu I
Někteří lidé trpí imunodeficiencí způsobenou defektem v TAP1 nebo TAP2. V buňkách s mutovanými TAP proteiny dochází k nižšímu transportu peptidů z cytosolu do lumen ER. MHC gp I tedy nejsou stabilizovány vazbou s peptidy, jsou translokovány zpět do cytosolu a degradovány.
Zkřížená prezentace
Na molekulách MHC I. třídy může docházet i k prezentaci peptidů z extracelulárních zdrojů. Jedná se o jev zvaný zkřížená prezentace (cross presentation). Materiál, který se nahromadí na povrchových receptorech buňky je endocytován a dostává se do endosomů. Zde může být částečně (nikoliv kompletně) degradován a transportován do cytoplazmy. Jinou cestou, jak se extracelulární peptidy mohou dostat na MHC molekuly I. třídy, je fúze pozdních fagozomů s peptidovými fragmenty s ER. Ukazuje se, že schopnost zkřížené prezentace není stejná u všech antigen prezentujících buněk. Nejúčinnější je u lidských a myších dendritických buněk.
Pohled do vazebného žlábku
Na MHC gp I. třídy se vážou peptidy dlouhé 8–10 aminokyselin. Je možné, že dochází k vazbě i delších peptidů – vážou se na C-konci a jsou následně štěpeny exopeptidázami přítomnými v Endoplazmatickém retikulu. Peptidy se do vazebné rýhy vážou v natažené konformaci.
Vazba peptidu na MHC gp I. třídy je stabilizována na obou koncích vazebného žlábku. Za hlavní stabilizující kontakt jsou považovány interakce mezi atomy na N- a C- konci peptidu a invariantními místy ležícími na obou koncích MHC žlábku (syntetické peptidy bez N- a C- konce nevytváří stabilní vazbu s MHC molekulou). V místě vazby N-koncové části peptidu se na MHC molekule nacházejí především tyrosinové zbytky. V místě vazby C-koncové části peptidu jsou na MHC molekule tyrosinové a lysinové zbytky. Tyto postranní aminokyselinové řetězce jsou zodpovědné za vznik vodíkových můstků a iontových interakcí, které stabilizují komplex MHC:peptid. Ostatní aminokyselinové zbytky v peptidu slouží jako „přídatné“ kotvy (additional anchors). Může však docházet k vazbě pouze na koncích peptidu a k „vyboulení“ jeho střední části.
Konce peptidů navázaných na molekuly MHC I. třídy jsou zanořeny v MHC molekule. Na MHC gp I. třídy se mohou vázat i chemicky modifikované peptidy (např. glykopeptidy). Nepeptidová složka je však vždy orientována ven z vazebné rýhy.
Invariantní aminokyseliny ve vazebné rýze rozeznávají rysy peptidové kostry, která je společná všem peptidům, zatímco polymorfní aminokyseliny ve vazebné rýze se vážou na specifické postranní řetězce peptidu.
Izotypy MHC gp I. třídy
Rozlišují se dvě skupiny MHC gp I. třídy: klasické a neklasické.
- Mezi klasické MHC gp I. třídy (označované také jako MHC Ia) patří HLA-A, HLA-B a HLA-C
- Zástupci neklasických MHC gp I. třídy (MHC Ib) jsou lidské HLA-E, HLA-F a HLA-G.
MHC Ia
HLA-C je ve srovnání s HLA-A a HLA-B méně polymorfní (cca 750 alel). I úroveň jeho exprese na povrchu buněk je ve srovnání s těmito izotypy menší. Výjimkou jsou buňky trofoblastu (na nich dochází k expresi HLA-C, -E a -G). Všechny varianty HLA-C se vážou na inhibiční receptory NK buněk a tím inhibují cytotoxickou aktivitu těchto leukocytů. Naproti tomu ne všechny alely HLA-A a –B jsou schopny tyto inhibiční receptory vázat. HLA-C se váže i na TCR, avšak jejich hlavní funkcí je vazba na NK buňky.
MHC Ib
Neklasické MHC gp I. třídy jsou méně polymorfní než MHC Ia. Jejich přesný počet se liší v závislosti na druhu, liší se i mezi jedinci v rámci jednoho druhu. Některé z molekul MHC Ib také asociují s β2-m. Jejich exprese na buňkách je variabilní, a to jak v jejich množství, tak i ve tkáňové distribuci.
- HLA-E (u myší označované jako Qa-1) vážou velmi omezenou skupinu nepolymorfních peptidů – vážou peptidy pocházející z N- koncové oblasti prekurzorů pro HLA-A, -B, -C a -G. HLA-E tedy prezentuje peptidy pocházející z ostatních MHC I molekul. Vazba komplexu HLA-E:peptid na NK-buňky způsobí inhibici cytotoxické aktivity NK-buněk. I HLA-F a -G mohou inhibovat cytotoxickou aktivitu NK-buněk.
- Exprese HLA-G je omezena na buňky trofoblastu (tj. placentální buňky fetálního původu, které migrují do děložní stěny). Tento izotyp se váže na inhibiční receptory NK buněk, avšak není prokázáno, že všechny děložní NK buňky tento typ receptoru exprimují.
- Molekuly HLA-F lze najít na buňkách různých tkání.
- Mezi neklasické MHC gp I. třídy jsou zařazovány i molekuly HFE a MIC a molekuly ze skupiny CD1.
- HFE (Human hemochromatosis gene; HLA-H) je membránový protein účastnící se metabolismu železa. V případě, že je tento protein mutován a je nefunkční, dochází k hemochromatóze – tělo přijímá velké množství železa z potravy.
- Molekuly MIC (MHC-class I related chain) jsou exprimovány na epiteliálních buňkách v nízké míře. Úroveň jejich exprese se zvyšuje při teplotním (či jiném) stresu, kdy dochází ke zvýšené tvorbě proteinů z rodiny Hsp.
- CD1 molekuly mají strukturně a funkčně k MHC Ib velmi blízko, nicméně tyto molekuly nejsou produkty genů ležících v MHC oblasti. CD1 asociují s β2-m, prezentují antigeny neproteinové povahy (např. lipidy) a jejich exprese je různá u různých typů buněk.
Cytokiny a jejich vliv na expresi MHC gp I. třídy
Klíčovými stimulátory vyšší exprese MHC gp I. třídy jsou interferony (IFN). Ty mimo jiné vedou i k indukci exprese molekul, které se účastní procesů vedoucím k „naložení“ peptidů na MHC molekulu. Dochází tedy ke zvýšení schopnosti prezentovat antigen. IFN α,β i γ vedou ke zvýšení exprese MHC gp I. třídy na všech buněčných typech. IFN jsou produkovány na počátku virové infekce.
Odkazy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
