Karcinom plic je onemocnění, při kterém dochází k nekontrolovanému buněčnému růstu v tkáni plic. Pokud není léčen, může se tento růst v rámci procesu zvaného metastázování rozšířit i mimo plíce do okolních tkání nebo dalších částí těla. Většina případů rakoviny, které začínají v plicích a jsou známy jako primární rakovina plic, jsou karcinomy vznikající z buněk epitelové tkáně. Hlavními typy rakoviny plic jsou malobuněčný karcinom plic (SCLC), rovněž známý jako „karcinom ovesných buněk“ (zhoubné buňky připomínají zrnka ovsa), a nemalobuněčný karcinom plic (NSCLC). Mezi nejběžnější symptomy onemocnění patří kašel (včetně vykašlávání krve), úbytek váhy a dechová nedostatečnost.[1]
Nejběžnější příčinou nemoci je dlouhodobé vystavení tabákovému kouři,[2] které stojí za 80–90 % případů rakoviny plic.[1] K 10–15 % případů tohoto onemocnění dochází u nekuřáků,[3] přičemž tyto případy jsou často přičítány kombinaci genetických faktorů,[4] vystavení vlivu radonu,[4] azbestu[5] a znečištění vzduchu,[4] včetně kouře z pasivního kouření.[6][7] Karcinom plic lze zobrazit pomocí rentgenu hrudníku a počítačové tomografie (CT snímek). Diagnóza je potvrzována prostřednictvím biopsie,[8] která se obvykle provádí za využití bronchoskopie nebo kontrolovaným CT vyšetřením. Léčba a dlouhodobé výsledky závisí na typu rakoviny, fázi (stupni rozšíření) a celkovém zdravotním stavu nemocného měřeném prostřednictvím hodnocení jeho celkového fyzického stavu.
Mezi běžné způsoby léčby patří chirurgický zákrok, chemoterapie a radioterapie. Nemalobuněčné karcinomy jsou někdy odstraňovány chirurgickým zákrokem, kdežto malobuněčné karcinomy obvykle lépe reagují na chemoterapii a radioterapii.[9] 15 % osob ve Spojených státech, u nichž je diagnostikována rakovina plic, přežije dalších pět let po stanovení diagnózy.[10] Celosvětově je rakovina plic nejběžnější příčinou úmrtí žen i mužů souvisejících s rakovinou a přičítá se jí 1,38 milionu úmrtí ročně (údaj k roku 2008).[11]
Mezi příznaky a symptomy, které mohou rakovinu plic naznačovat, patří:[1]
- respirační symptomy: kašel, vykašlávání krve, sípání nebo dýchavičnost
- systémové symptomy: úbytek hmotnosti, horečka, paličkovité prsty nebo únava
- symptomy způsobené místním tlakem: bolest na prsou, bolesti v kostech, syndrom horní duté žíly, potíže s polykáním
Pokud se karcinom tvoří v dýchacích cestách, může ztěžovat proudění vzduchu a zapříčinit tak dýchavičnost. Ucpání dýchacích cest může vést k nahromadění sekretu za místem ucpání a způsobit zápal plic.[1] V závislosti na typu tumoru může na možnost karcinomu plic zpočátku ukázat tzv. paraneoplastický syndrom.[12] V případě karcinomu plic mohou projevy tohoto syndromu zahrnovat Lambert–Eatonův myastenický syndrom (svalová slabost způsobená autoprotilátkami), hyperkalcemii nebo syndrom nedostatečné produkce antidiuretického hormonu (SIADH). Tumory v horní části plic, známé jako Pancoastovy tumory, mohou narušit místní část sympatického nervového systému a vést tak k Hornerově syndromu (pokles očního víčka a malá oční panenka na postižené straně) a k poškození brachiálního plexu.[1]
Mnoho ze symptomů karcinomu plic (nechuť k jídlu, úbytek hmotnosti, horečka, únava) není specifických.[8] U mnoha osob, které v okamžiku projevu symptomů vyhledají lékařskou pomoc, je již rakovina rozšířena i mimo původní ložisko. Mezi běžná místa, kam se rakovina dále šíří, patří mozek, kosti, nadledvinky, druhá plíce, játra, osrdečník a ledviny.[13] Přibližně 10 % osob s karcinomem plic nemá v okamžiku diagnózy žádné symptomy; k nálezu karcinomu obvykle dochází náhodně při rutinním rentgenu hrudníku.[10]
K rozvoji karcinomu dochází v důsledku genetického poškození DNA. Toto genetické poškození postihuje normální funkci buňky včetně její schopnosti množení, programované buněčné smrti (apoptózy) a schopnosti opravy DNA. Čím větší je poškození, tím vyšší je riziko vzniku karcinomu.[14]
Kouření


Kouření, zejména pak kouření cigaret, přispívá ke vzniku karcinomu plic zdaleka nejvíce.[15] Cigaretový kouř obsahuje více než 60 známých karcinogenů,[16] mezi něž patří radioizotopy z rozpadové řady radonu, z nitrosaminu a benzopyrenu. Rovněž se zdá, že nikotin potlačuje imunitní odezvu na rakovinotvorný růst ve tkáni vystavené těmto vlivům.[17] V rozvinutých zemích bylo 90 % úmrtí mužů na karcinom plic v roce 2000 přičítáno kouření (70 % u žen).[18] Kouření se přičítá 80–90 % všech případů karcinomu plic.[1]
U nekuřáků je příčinou vzniku karcinomu plic pasivní kouření - vdechování kouře vznikajícího při kouření jiných osob. Jako pasivního kuřáka lze označit člověka, který žije nebo pracuje v blízkosti kuřáka. Studie provedené ve Spojených státech,[19][20]Evropě,[21] Spojeném království[22] a v Austrálii[23] konzistentně prokázaly značně zvýšené riziko vzniku rakoviny u osob vystavených pasivnímu kouření.[24] U těch, kdo žijí s kuřákem, je riziko vyšší asi o 20–30 %, zatímco u osob, které pracují v prostředí ovlivňovaném kouřem z cigaret jiných lidí, je riziko vyšší o 16–19 %.[25] Výzkum vlivu postranního proudu kouře naznačuje, že tento kouř je ještě nebezpečnější než kouř přímo vdechovaný kuřákem.[26] Ve Spojených státech je pasivní kouření příčinou přibližně 3 400 úmrtí na karcinom plic ročně.[20]
Radon
Radon je plyn bez barvy a zápachu vznikající rozpadem radioaktivního rádia, které je pro změnu produktem rozpadu uranu vyskytujícího se v zemské kůře. Produkty rozpadu radioaktivních látek ionizují genetický materiál a způsobují mutace, které se někdy stávají rakovinnými. Po kouření je radon druhou nejběžnější příčinou karcinomu plic ve Spojených státech.[20] S každými 100 becquerely/m³ koncentrace radonu se riziko zvyšuje o 8-16 %.[27]Množství radonu se liší v závislosti na lokalitě a složení půdy a hornin v podloží. Například v oblastech, jako je Cornwall ve Spojeném království (kde je žulové podloží), je radon velkým problémem. Pro snížení koncentrace radonu musí být budovy uměle větrány. Americká Agentura pro ochranu životního prostředí (EPA) odhaduje, že v jednom z 15 domů ve Spojených státech je hladina radonu vyšší než je doporučený limit 4 pikocurie na litr (pCi/l) (148 Bq/m³).[28]
Azbest
Azbest může způsobit řadu onemocnění plic, včetně karcinomu plic. Kouření tabáku a vystavení azbestu má na tvorbu karcinomu plic synergický efekt.[5] Azbest může rovněž způsobit rakovinu pohrudnice, která se nazývá mezoteliom (a která se od karcinomu plic liší).[29]
Znečištění vzduchu
Znečištění vzduchu má na zvýšení rizika karcinomu plic malý účinek.[4] Jemné částice (PM2,5) a sulfátové aerosoly, které se mohou dostávat do ovzduší ve výfukových plynech, jsou spojovány s mírně zvýšeným rizikem.[4][30] U oxidu dusičitého každý přírůstek 10 částic na jednu miliardu částic vzduchu zvyšuje riziko karcinomu plic o 14 %.[31] Znečištění vzduchu se připisuje 1–2 % případů karcinomu plic.[4]
Předběžné důkazy podporují hypotézu zvýšeného rizika vzniku karcinomu plic v důsledku znečištění vzduchu v interiéru v souvislosti se spalováním dřeva, uhlí, zvířecího trusu nebo zbytků rostlin při vaření nebo topení.[32] U žen, které jsou v interiéru vystaveny kouři z uhlí, je riziko přibližně dvojnásobné; řada vedlejších produktů spalování biomasy je známými nebo domnělými karcinogeny.[33] Toto riziko se týká přibližně 2,4 miliardy lidí na celém světě[32] a má se za to, že stojí za 1,5 % úmrtí na karcinom plic.[33]
Genetika
Odhaduje se, že 8 až 14 % případů karcinomu plic je způsobeno dědičnými faktory.[34] U osob příbuzných nemocnému s karcinomem plic je riziko 2,4 krát vyšší. Je tomu tak pravděpodobně v důsledku kombinace genů.[35]
Další příčiny
S karcinomem plic je spojována řada dalších látek, povolání a vystavení vlivům okolního prostředí. Mezinárodní agentura pro výzkum rakoviny (IARC) uvádí, že existují „dostatečné důkazy“ pro to, že přítomnost následujících látek v plicích je karcinogenní:[36]
- Některé kovy (výroba hliníku, kadmium a sloučeniny kadmia, sloučeniny chromu (VI), berylium a sloučeniny berylia, železné a ocelové slitiny, sloučeniny niklu, arsen a anorganické sloučeniny arsenu, podzemní těžba hematitu)
- Některé produkty spalování (nedokonalé spalování, uhlí (emise ze spalování uhlí v domácnostech), uhelné plyny, černouhelná smůla, výroba koksu, saze, výfukové plyny z naftových motorů)
- Ionizující záření (rentgen, radon 222 a produkty jeho rozpadu, gama záření, plutonium)
- Některé toxické plyny (metyléter (technický stupeň čistoty), bis(chlormetyl)éter, yperit, MOPP (směs vinkristin-prednison-dusíkatý yperit-prokarbazin), výpary z nátěrů)
- Výroba pryže a krystalický křemenný prach
Podobně jako u mnoha dalších typů rakoviny začíná karcinom plic aktivací onkogenů nebo deaktivací genů bránících vzniku tumoru.[37] Má se za to, že onkogeny činí člověka náchylnějším k rozvoji rakoviny, a zdá se, že protoonkogeny se po vystavení působení konkrétních karcinogenů mění právě na onkogeny.[38] Mutace protoonkogenu K-ras způsobují 10–30 % případů adenokarcinomu plic.[39][40] Receptor pro epidermální růstový faktor (EGFR) reguluje množení buněk, apoptózu, angiogenezi a invazi tumoru.[39] Mutace a zvětšení receptorů EGFR jsou běžné u nemalobuněčného karcinomu plic a představují základ pro léčbu pomocí inhibitorů EGFR. Receptor Her2/neu je postihován méně častěji.[39] Poškození chromozomů může vést ke ztrátě heterozygozity, a tedy potenciálně k deaktivaci genů zabraňujících vzniku tumoru. Pro malobuněčný karcinom plic je běžné poškození zejména chromozomů 3p, 5q, 13q a 17p. Gen p53, který zabraňuje vzniku tumoru a který se nachází na chromozomu 17p, je postihován v 60-75 % případů.[41] Mezi další geny, k jejich mutaci či změnám často dochází, patří c-MET, NKX2-1,LKB1, PIK3CA a BRAF.[39]
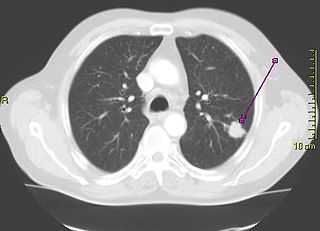
Provedení rentgenu hrudníku je jedním z prvních kroků při vyšetření osoby trpící symptomy, jež by mohly naznačovat karcinom plic. Může odhalit přítomnost tumoru, rozšíření mezihrudí (naznačující, že tumor napadl lymfatické uzliny), atelektázu (kolaps), konsolidaci plic (pneumonii) nebo pleurální efuzi.[2] Ke zjištění detailnějších informací o typu a rozsahu onemocnění se typicky používá CT snímkování. Bronchoskopie nebo CT snímkováním řízená biopsie často slouží k odebrání vzorku tumoru pro účely histopatologie.[10]
Rakovina plic se na rentgenu hrudníku často objevuje jako solitární plicní uzel. Diferenciální diagnostika však uvádí řadu dalších onemocnění s podobným symtomem. Stejný příznak může způsobit i tuberkulóza, plísňové infekce, metastatická rakovina nebo organizující se pneumonie. Mezi méně běžné příčiny solitárního plicního uzlu patří hamartomy, bronchogenní cysty, adenomy, arteriovenózní malformace, plicní sekvestrace, revmatoidní uzlíky, Wegenerova granulomatóza nebo lymfom.[42] Karcinom plic může být odhalen i náhodně jako solitární plicní uzel na rentgenovém nebo CT snímku hrudníku pořízeném pro jiný, nesouvisející účel.[43]Definitivní diagnóza karcinomu plic se stanovuje na základě histologického vyšetření podezřelé tkáně z hlediska klinického a radiologického.[1]
Klasifikace
| Histologický ytp | Počet případů na 100 000 osob a rok |
|---|---|
| Všechny typy | 66,9 |
| Adenokarcinom | 22,1 |
| Spinocelulární karcinom | 14,4 |
| Malobuněčný karcinom | 9,8 |
Karcinomy plic jsou klasifikovány podle histologického typu.[8] Tato klasifikace je důležitá pro určení způsobu léčby a předvídání dalšího vývoje nemoci. V naprosté většině případů rakoviny plic se jedná o karcinomy—zhoubné bujení buněk epitelové tkáně. Karcinomy plic se rozdělují do kategorií podle velikosti a vzhledu buněk zhoubné tkáně tak, jak ji pod mikroskopem vidí histopatolog. Dvěma hlavními skupinami jsou nemalobuněčné a malobuněčné karcinomy plic.[44]
Nemalobuněčný karcinom plic

Třemi hlavními podtypy nemalobuněčného karcinomu plic jsou adenokarcinom, spinocelulární karcinom plic a velkobuněčný karcinom plic.[1]
Téměř 40 % karcinomů plic jsou adenokarcinomy, které obvykle vznikají v okrajové plicní tkáni.[8] Většina případů adenokarcinomů souvisí s kouřením, avšak i u osob, které za svůj život vykouřily méně než 100 cigaret (a lze je tak označit za „nekuřáky“),[1] je adenokarcinom nejběžnější formou rakoviny plic.[45] Podtyp adenokarcinomu označovaný jako bronchioloalveolární karcinom je obvyklejší u žen-nekuřaček a je spojován s delší pravděpodobnou dobou přežití.[46]
Spinocelulární karcinom stojí za přibližně 30 % případů rakoviny plic. Tento typ karcinomu se typicky objevuje v blízkosti velkých cest dýchacích. Ve středu tumoru se obvykle nachází dutina a mrtvá tkáň.[8]Přibližně 9 % rakoviny plic jsou velkobuněčné karcinomy. Jsou tak pojmenovány proto, že buňky karcinomu jsou velké, s množstvím cytoplazmy, velkými jádry a nápadnými jadérky.[8]
Malobuněčný karcinom plic

V případě malobuněčných karcinomů plic (SCLC) buňky obsahují kompaktní neurosekreční granula (váčky naplněné neuroendokrinními hormony), které by u tohoto tumoru mohly naznačovat souvislost s endokrinním/paraneoplastickým syndromem.[47] Ve většině případů se karcinomy objevují ve velkých cestách dýchacích (primární a sekundární průdušky).[10]Tyto typy karcinomu rychle rostou a šíří se již v rané fázi onemocnění. V šedesáti až sedmdesáti procentech případů u nich dochází k metastázím. Tento typ rakoviny plic velmi významně souvisí s kouřením.[1]
Další typy karcinomu
Rozeznáváme čtyři hlavní histologické podtypy, ačkoli některé karcinomy mohou být tvořeny kombinací různých podtypů.[44] Mezi vzácné podtypy patří nádory žláz, karcinoidní tumory a nediferencované karcinomy.[1]
Šíření metastáz
| Histologický ytp | Imunozbarvení |
|---|---|
| Spinocelulární karcinom | CK5/6 pozitivní CK7 negativní |
| Adenokarcinom | CK7 pozitivní TTF-1 pozitivní |
| Velkobuněčný karcinom | TTF-1 negativní |
| Malobuněčný karcinom | TTF-1 pozitivní CD56 pozitivní Chromogranin pozitivní Synaptofyzin pozitivní |
Plíce jsou místem, kam se běžně rozšiřují tumory z jiných částí těla. Sekundární karcinomy jsou klasifikovány podle místa jejich vzniku; například karcinom prsu, který se rozšířil do plic, se nazývá metastatický karcinom prsu. Na rentgenovém snímku mají metastázy často charakteristický zakulacený vzhled.[48]
Primární karcinomy plic nejběžněji metastázují do mozku, kostí, jater a nadledvinek.[8] Imunozbarvení během biopsie je často užitečné pro určení původního zdroje.[49]
Klasifikace stádií
Klasifikace stádií karcinomu plic je posouzení stádia rozšíření karcinomu z jeho původního zdroje. Je jedním z faktorů ovlivňujících prognózu a potenciální způsob léčby karcinomu plic.[1]
Počáteční vyhodnocení stádia nemalobuněčného karcinomu plic (NSCLC) využívá klasifikaci TNM. Ta je založena na velikosti primárního tumoru, postižení lymfatických uzlin (lymph node) a vzdálenosti metastáz. Poté je za využití těchto TNM deskriptorů karcinom zařazen do jedné ze skupin - od okultní (skryté) fáze karcinomu až po stádia 0, IA (jedna A), IB, IIA, IIB, IIIA, IIIB a IV (čtyři). Toto rozdělení stádií do skupin napomáhá určení způsobu léčby a odhadu prognózy.[50]
Malobuněčné karcinomy plic (SCLC) jsou tradičně klasifikovány jako karcinomy „nepokročilého stádia“ (rozšíření pouze do poloviny hrudníku a v rozsahu jednoho radiačního pole s využitím radioterapie únosného stupně) nebo jako karcinomy „pokročilého stádia“ (výraznější rozšíření onemocnění).[1] I tak je ale klasifikace TNM a zařazení do jedné ze skupin užitečné při odhadu prognózy.[50]
V případě NSCLC i SCLC jsou dvěma hlavními hledisky posouzení pokročilosti nemoci klinická a chirurgická klasifikace stádia. Klinická klasifikace stádia se provádí před samotným chirurgickým zákrokem. Je založena na výsledcích snímkování (například CT snímky a PET snímky) a na výsledcích biopsie. Chirurgická klasifikace stádia je vyhodnocena během operace nebo po ní a základem pro ni jsou kombinované výsledky chirurgických a klinických nálezů včetně chirurgicky odebraného vzorku hrudních lymfatických uzlin.[8]
Prevence je z hlediska nákladů nejefektivnějším prostředkem ke snižování počtu případů karcinomu plic. Ačkoli ve většině zemí byly karcinogeny v domácím i průmyslovém prostředí identifikovány a zakázány, kouření tabáku je stále velmi rozšířené. Eliminace kouření tabáku je primárním cílem prevence rakoviny plic a skoncování s kouřením je v rámci tohoto procesu důležitým nástrojem prevence.[51]
Opatření a zásahy k omezení pasivního kouření na veřejných místech, například v restauracích a na pracovištích, jsou nyní běžné v mnoha západních zemích.[52] Bhútán zavedl úplný zákaz kouření v roce 2005,[53] Indie uplatňuje zákaz kouření na veřejných místech od října 2008.[54] Světová zdravotnická organizace vyzývá vlády, aby prosadily úplný zákaz reklamy tabákových výrobků, aby mladí lidé s kouřením vůbec nezačínali. Tato organizace soudí, že tam, kde byl tento zákaz zaveden, spotřeba tabákových výrobků klesla o 16 %.[55]
Dlouhodobé užívání doplňkového vitaminu A,[56][57] vitaminu C,[56] vitaminu D[58] nebo vitaminu E[56] riziko vzniku rakoviny plic nesnižuje. Na základě některých studií se zdá, že pro lidi, kteří konzumují v potravě vyšší množství zeleniny a ovoce, je obvyklé nižší riziko onemocnění rakovinou,[20][59] to je však pravděpodobně výsledek zavádějících faktorů. Preciznější studie jasnou souvislost neprokázaly.[59]
Screening
Screening je využití lékařských vyšetření s cílem rozpoznat jistou chorobu u osob bez symptomů. Lékařská vyšetření, s jejichž pomocí lze rakovinu plic určit, zahrnují cytologické vyšetření sputa, rentgen plic (RTG plic) a počítačovou tomografii (CT). Screeningové programy využívající RTG plic nebo cytologické vyšetření neprokázaly podstatný přínos.[60] Každoroční vyšetření osob podléhajících vysokému riziku (tedy ve věku 55 až 79 let, které kouřily více než 30 balíčkoroků nebo které v minulosti trpěly rakovinou plic) pomocí CT snímkování o snížených dávkách záření může snížit riziko úmrtí na rakovinu plic o absolutní hodnotu 0,3 % (relativní hodnota 20 %).[61][62] Počet falešně pozitivních CT snímků je však značný a může vyústit v řadu nepotřebných invazivních zákroků i značné finanční náklady.[63] Na každý skutečně pozitivní snímek připadá více než 19 falešně pozitivních.[64] Dalším potenciálním rizikem je vystavení pacientů záření během CT snímkování.[65]
Léčba rakoviny plic závisí na specifickém typu rakovinných buněk, pokročilosti onemocnění a na tom, jaký je celkový fyzický stav nemocného. Běžné léčebné postupy zahrnují paliativní péči,[66] chirurgický zákrok, chemoterapii a radioterapii.[1]
Chirurgický zákrok

Pokud vyšetření potvrdí nemalobuněčný karcinom plic, musí být posouzena fáze pokročilosti rakoviny, aby bylo možno určit, zda je onemocnění lokalizováno a řešitelné operací či zda se natolik rozšířilo, že operativní zákrok by již neměl smysl. K tomu se využívá počítačová tomografie a pozitronová emisní tomografie.[1] Pokud existuje podezření, že jsou zasaženy i mezihrudní lymfatické uzliny, lze pro odebrání vzorků z uzlin a stanovení pokročilosti nemoci využít mediastinoskopii.[67] K posouzení skutečnosti, zda je nemocný schopen operaci podstoupit, se využívají i rozbory krve a vyšetření funkce plic.[10] Pokud vyšetření plic odhalí slabou respirační rezervu, chirurgický zákrok pravděpodobně nebude vhodným řešením.[1]
Ve většině případů raného nemalobuněčného karcinomu plic se upřednostňuje odstranění plicního laloku (lobektomie). U těch osob, jejichž celkový stav nedovoluje lobektomii celého laloku, lze provést resekci menšího rozsahu (klínovitá resekce). U tohoto typu resekce však existuje vyšší riziko recidivy rakoviny než u lobektomie.[68] Radioaktivní brachyterapie jodovými zrny v okrajových oblastech klínovité excize může riziko recidivy snížit.[69]Velmi zřídka se provádí odstranění celé plíce (pneumonektomie).[68] Videoasistovaná torakoskopická operace a videoasistovaná lobektomie jsou založeny na minimálně invazivním postupu při operaci rakoviny plic.[70] Videoasistovaná lobektomie je ve srovnání s konvenční otevřenou lobektomií stejně efektivní, navíc však není v takovém množství doprovázena postoperačními onemocněními.[71]
U malobuněčného karcinomu plic se obvykle používá chemoterapie a/nebo radioterapie.[72] Význam chirurgického zákroku pro léčbu malobuněčného karcinomu plic je však předmětem úvah. V rané fázi SCLC může operační zákrok zlepšit možné výsledky, pokud je doprovázen chemoterapií a radioterapií.[73]
Radioterapie
Radioterapie neboli ozařování se často kombinuje s chemoterapií a u osob trpících NSCLS, které nemohou podstoupit chirurgický zákrok, může být kurativně cílená. Tato forma vysoce intenzivní radioterapie se nazývá radikální radioterapie.[74] Zpřesněnou formou tohoto postupu je kontinuální hyperfrakcionovaná akcelerovaná terapie (CHART), během níž je pacient vystaven vysoké dávce radioterapie v krátkém časovém úseku.[75] Pooperační radioterapie hrudní stěny by obecně po kurativní operaci NSCLC neměla být použita,[76] může být ale prospěšná pro nemocné, jejichž mezihrudní lymfatické uzliny N2 byly nemocí zasaženy.[77]
U potenciálně vyléčitelných případů malobuněčného karcinomu plic se často doporučuje radioterapie hrudníku jako doplněk k chemoterapii.[8]
Pokud rakovinný nádor blokuje krátký úsek průdušky, může lékař použít brachyterapii (lokalizovanou radioterapii), a to přímo v dýchacích cestách, aby byla obnovena jejich průchodnost.[78]Ve srovnání s radioterapií externím paprskem umožňuje brachyterapie zkrácení doby léčby a nižší vystavení radioaktivnímu záření pro zdravotníky.[79]
Profylaktická kraniální iradiace (PCI) je typem radioterapie mozku, užívaným ke snížení rizika vzniku metastáz. Tento léčebný postup je nejvhodnější pro malobuněčný karcinom plic. U nepokročilé fáze nemoci zvyšuje míru tříletého přežití z 15 % na 20 %; u onemocnění v pokročilém stadiu se jednoleté přežití zvyšuje z 13 % na 27 %.[80]
Nedávná zlepšení technik zacílení a zobrazování vedla ke vzniku stereotaktického ozařování při léčbě raných fází rakoviny plic. Při této formě radioterapie je pacient vystaven vysokým dávkám záření při malém počtu vyšetření za použití stereotaktických lokalizačních technik. Využívá se zejména u pacientů, kteří v důsledku souběžných onemocnění nemohou podstoupit chirurgický zákrok.[81]
Ke kontrole symptomů u pacientů trpících nemalobuněčným i malobuněčným karcinomem plic lze využít ozařování hrudníku v menších dávkách (paliativní radioterapie).[82]
Chemoterapie
Nasazení léčby chemoterapií závisí na typu nádoru.[8] Malobuněčný karcinom plic (SCLC), a to i relativně raná fáze nemoci, se léčí především chemoterapií a radioterapií.[83] U malobuněčného karcinomu plic se nejčastěji užívá cisplatina a etoposid.[84] Kombinují se také s karboplatinou, gemcitabinem,paklitaxelem, vinorelbinem, topotecanem a irinotecanem.[85][86] U pokročilého nemalobuněčného karcinomu plic (NSCLC) zvyšuje chemoterapie pravděpodobnost přežití a užívá se jako primární léčba za předpokladu, že nemocný je schopen tuto léčbu podstoupit.[87] Obvykle se podávají dva léčivé přípravky, z nichž jeden je vždy na bázi platiny (buď cisplatina nebo karboplatina). K dalším často užívaným lékům patří gemcitabin, paklitaxel, docetaxel,[88][89] pemetrexed,[90] etoposid a vinorelbin.[89]
Adjuvantní chemoterapie označuje nasazení chemoterapie po léčebném chirurgickém zákroku za účelem zlepšení vyhlídky léčení. U nemalobuněčného karcinomu jsou z blízkých lymfatických uzlin během zákroku odebrány vzorky, jež pak slouží k určení fáze pokročilosti nemoci. Pokud je potvrzena II. či III. fáze onemocnění, může adjuvantní chemoterapie zvýšit míru přežití v následujících pěti letech o 5 %.[91][92] Kombinované podávání vinorelbinu a cisplatiny vykazuje vyšší účinek než dřívější metody léčby.[92] Adjuvantní chemoterapie u osob trpících rakovinou ve fázi IB je kontroverzní, neboť klinické studie neprokázaly jasně její přínos pro délku přežití.[93][94] Studie zaměřené na výzkum předoperační chemoterapie (neoadjuvantní chemoterapie) u resektabilního nemalobuněčného karcinomu nepřinesly jednoznačný závěr.[95]
Paliativní péče
U osob trpících terminálním onemocněním může být vhodná paliativní péče či pobyt v hospici.[10] Tyto způsoby péče umožňují dodatečnou diskusi o možnostech léčby a nabízejí příležitost dobře zvážit všechna rozhodnutí;[96][97] mohou také předejít nevhodné a nákladné péči v závěrečné fázi života nemocného.[97]
Při léčbě nemalobuněčného karcinomu plic lze chemoterapii kombinovat s paliativní péčí. U pokročilých případů zlepšuje vhodná chemoterapie průměrnou dobu přežití ve srovnání s pouhým využitím podpůrné péče, a zvyšuje také kvalitu života.[98] U nemocných s adekvátní tělesnou zdatností umožňuje udržovací chemoterapie nasazená v rámci paliativní péče prodloužení života o 1,5 až 3 měsíce, úlevu od symptomů a zlepšení kvality života. U moderních prostředků jsou zaznamenané výsledky lepší.[99][100] Spolupracující skupina odborníků pro metaanalýzu nemalobuněčného karcinomu plic doporučuje, aby u případů karcinomu plic v pokročilém stadiu byla zvážena chemoterapie, pokud s ní nemocný souhlasí a je schopen ji podstoupit.[87][101]
| Klinické stadium | Pětileté přežití (%) | |
|---|---|---|
| Nemalobuněčný karcinom plic | Malobuněčný karcinom plic | |
| IA | 50 | 38 |
| IB | 47 | 21 |
| IIA | 36 | 38 |
| IIB | 26 | 18 |
| IIIA | 19 | 13 |
| IIIB | 7 | 9 |
| IV | 2 | 1 |
Prognóza je obecně špatná. Z osob diagnostikovaných s rakovinou plic přežije prvních pět let od diagnózy 15 % z nich.[2] V době diagnózy je stadium nemoci již často pokročilé. Při prvním projevu onemocnění je ve fázi IV 30–40 % případů nemalobuněčného karcinomu a 60 % případů malobuněčného karcinomu.[8]
Prognostické faktory nemalobuněčného karcinomu plic zahrnují výskyt příznaků plicní choroby, velikost tumoru, buněčný typ (histologie), stupeň rozšíření (pokročilost), metastázy v mnohočetných lymfatických uzlinách a vaskulární invazi. U osob s neoperovatelným onemocněním jsou možné výsledky horší u skupiny se špatným celkovým fyzickým stavem a více než 10% úbytkem hmotnosti.[102] K prognostickým faktorům malobuněčného karcinomu plic patří celkový fyzický stav, pohlaví, stadium nemoci a zasažení centrálního nervového systému či jater v okamžiku diagnózy.[103]
U nemalobuněčného karcinomu plic je nejlepší prognózy dosaženo kompletní chirurgickou resekcí ve stadiu IA. Přežití po pěti letech pak činí až 70 %.[104] U malobuněčného karcinomu je celková míra přežití po pěti letech kolem 5 %.[1] Nemocní s pokročilým malobuněčným karcinomem plic mají průměrnou šanci na pětileté přežití nižší než 1 %. Průměrná doba přežití u nemocných v nepokročilé fázi nemoci je 20 měsíců, míra pětiletého přežití pak 20 %.[2]
Na základě údajů poskytnutých Národním ústavem pro léčbu rakoviny je průměrný věk při diagnóze rakoviny plic ve Spojených státech 70 let,[105] průměrný věk při úmrtí na následky nemoci pak 72 let.[106] Nemocní se zdravotním pojištěním mají ve Spojených státech větší nadějí na lepší výsledek léčby.[107]

údaje nejsou k dispozici
≤ 5
5-10
10-15
15-20
20-25
25-30
30-35
35-40
40-45
45-50
50-55
≥ 55

Na celém světě je rakovina plic nejčastější formou rakoviny jak ve smyslu výskytu, tak úmrtnosti. V roce 2008 bylo zaznamenáno 1,61 milionu nových případů a 1,38 milionu úmrtí na následky rakoviny plic. Nejvyšší četnost výskytu nemoci je v Evropě a Severní Americe.[11] Populační skupina, u níž je pravděpodobnost vzniku onemocnění nejvyšší, jsou osoby starší 50 let, které v minulosti kouřily. V protikladu k úmrtnosti mužů, která začala před více než 20 lety klesat, má úmrtnost na rakovinu plic u žen v posledních dvou dekádách stoupající tendenci, a teprve v poslední době se začala stabilizovat.[109] V USA je celoživotní riziko onemocnění rakovinou plic 8 % u mužů a 6 % žen.[1]
Na každé 3-4 miliony vykouřených cigaret připadá jedno úmrtí na rakovinu plic.[1][110] Vliv velkých tabákových společností, tzv. "Big Tobacco", hraje v kultuře kouření podstatnou roli.[111] U mladých nekuřáků, obklopených reklamou na tabákové výrobky, je vyšší pravděpodobnost, že začnou kouřit.[112] Vliv pasivního kouření je při vzniku rakoviny plic ve stále vyšší míře uznáván jako rizikový faktor,[24] což vede k úpravě zákonů s cílem snížit nežádoucí vystavení nekuřáků tabákovému kouři.[113] Potenciální riziko představují také emise z automobilů, továren a elektráren.[4]
Ve východní Evropě byla zaznamenána nejvyšší úmrtnost na následky rakoviny plic mezi muži, zatímco v severní Evropě a USA je nejvyšší úmrtnost na následky této nemoci mezi ženami. Ve Spojených státech je výskyt rakoviny vyšší u černošských žen a mužů.[114] Výskyt rakoviny plic v rozvojových zemích je v současné době omezený.[115] Počet kuřáků v těchto státech ale stoupá, a proto se očekává nárůst výskytu této nemoci v několika následujících letech, a to zejména v Číně[116] a Indii.[117]
Od 60. let 20. století začala četnost výskytu adenokarcinomu plic ve srovnání s jinými typy rakoviny plic stoupat. Příčinou je hlavně zahájení prodeje cigaret s filtrem. Použití filtru odstraňuje z tabákového kouře větší částice a omezuje ukládání nánosu ve velkých dýchacích cestách. Kuřák však musí vdechovat hlouběji, aby dostal tutéž dávku nikotinu, a tím dochází ke zvýšenému ukládání částic v malých dýchacích cestách, kde obvykle adenokarcinom vzniká.[118] Četnost výskytu adenokarcinomu plic se tak neustále zvyšuje.[119]
Před příchodem kouření cigaret byla rakovina plic poměrně řídkým onemocněním, a až do roku 1761 nebyla dokonce chápána jako specifická nemoc.[120] V roce 1810 byla řada aspektů rakoviny plic popsána podrobněji.[121]Zhoubné nádory plic tvořily v roce 1878 pouze 1 % všech typů rakoviny potvrzené při pitvě, na počátku 20. století však tento počet vzrostl na 10–15 %.[122] V roce 1912 bylo v odborné literatuře zaznamenáno celosvětově pouze 374 případových studií,[123]revize pitev však prokázala, že výskyt rakoviny plic vzrostl z 0,3 % v roce 1852 na 5,66 % v roce 1952.[124] Roku 1929 rozpoznal lékař Fritz Lickint v Německu souvislost mezi kouřením a rakovinou plic,[122] což vedlo k razantní protikuřácké kampani.[125] Studie britských lékařů, publikovaná v 50. letech 20. století, je považována za první solidní epidemiologický důkaz souvislosti mezi rakovinou plic a kouřením.[126] V důsledku toho doporučil v roce 1964 vedoucí amerického úřadu pro zdravotnictví, aby kuřáci od kouření upustili.[127]
Vliv vzácného plynu radonu na vznik rakoviny plic byl poprvé zaznamenán u horníků z Krušných hor poblíž Schneebergu v Sasku. Stříbro se tam těžilo od roku 1470; tyto doly jsou bohaté na uran, jehož výskyt je doprovázen přítomností rádia a radonu.[128] Horníci byli v nepřiměřeně vysoké míře postihováni plicní chorobou, jež byla v 70. letech 19. století nakonec potvrzena jako rakovina plic.[129] Navzdory tomu dolování pokračovalo až do 50. let 20. století, a to zejména v důsledku poptávky po uranu v SSSR.[128] V 60. letech 20. století bylo prokázáno, že radon rakovinu plic skutečně způsobuje.[130]
První úspěšná pneumonektomie u rakoviny plic byla provedena v roce 1933.[131] Paliativní radioterapie se používá od 40. let 20. století.[132] Radikální radioterapie, poprvé uplatněná v 50. letech 20. století, byla pokusem o nasazení vyšších dávek radiace u pacientů v relativně rané fázi rakoviny plic, kteří však z různých důvodů nemohli podstoupit chirurgický zákrok.[133] Kontinuální hyperfrakcionovaná akcelerovaná terapie byla v roce 1997 chápána ve srovnání s konvenční radikální radioterapií jako krok vpřed.[134] Počáteční pokusy o chirurgickou resekci[135] a radikální radioterapii[136] z 60. let 20. století u malobuněčného karcinomu plic byly neúspěšné. V další dekádě pak byla úspěšně vyvinuta léčba chemoterapií.[137]
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.