chemická sloučenina From Wikipedia, the free encyclopedia
Trikarbonyl (benzylidenaceton)železa (zkráceně (bda)Fe(CO)3) je organická sloučenina se vzorcem (C6H5CH=CHC(O)CH3)Fe(CO)3. Používá se jako přenašeč Fe(CO)3.[1]
| Trikarbonyl (benzylidenaceton)železa | |
|---|---|
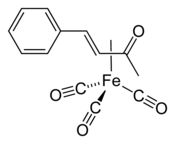 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | trikarbonyl (benzylidenaceton)železa |
| Sumární vzorec | C13H10FeO4 |
| Vzhled | červená pevná látka |
| Identifikace | |
| Registrační číslo CAS | 38333-35-6 |
| PubChem | 11403415 |
| SMILES | [Fe].[O+]#[C-].[O+]#[C-].[O+]#[C-].O=C(\C=C\c1ccccc1)C |
| InChI | InChI=1S/C10H10O.3CO.Fe/c1-9(11)7-8-10-5-3-2-4-6-10;3*1-2;/h2-8H,1H3;;;;/b8-7+;;;; |
| Vlastnosti | |
| Molární hmotnost | 286,06 g/mol |
| Teplota tání | 88 až 89 °C (361 až 362 K) |
| Rozpustnost ve vodě | málo rozpustný |
Některá data mohou pocházet z datové položky. | |
(bda)Fe(CO)3 je komplex η2-ketonu. V infračerveném spektru má (v cyklohexanovém roztoku) absorpční pásy 2065, 2005 a 1985 cm−1, tři pásy naznačují nízkou symetrii tohoto chirálního komplexu.

Trikarbonyl (benzylidenaceton)železa se připravuje reakcí nonakarbonylu diželeza (Fe2(CO)9) s benzylidenacetonem.[2]
(bda)Fe(CO)3 reaguje s Lewisovými zásadami za vzniku aduktů, aniž by došlo k oddělení benzylidenacetonu (bda).[3]
Jako zdroj Fe(CO)3 se také používá Fe2(CO)9 nebo Fe(CO)3(cyklookten)2, který je vysoce reaktivní, ovšem nestálý za vyšších teplot. Iminové deriváty cinnamaldehydu, například C6H5CH=CHC(H)=NC6H5, také vytvářejí s Fe(CO)3 reaktivní adukty, jež mohou být v některých oblastech vhodnější než (bda)Fe(CO)3.[4]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.