fyziologický proces, kdy se na krátký okamžik membránový potenciál buňky rychle zvýší a zase sníží From Wikipedia, the free encyclopedia
Akční potenciál (zkratka AP) je ve fyziologii krátký okamžik, kdy se membránový potenciál buňky rychle zvýší a zase sníží. Tato změna se dále šíří jedním směrem. Akční potenciály se vyskytují u rostlinných buněk a u několika typů živočišných buněk, u takzvaných vzrušivých buněk. Mezi ně patří neurony, svalové buňky a endokrinní buňky. U neuronů hraje AP hlavní roli při mezibuněčné komunikaci. U ostatních druhů buněk je jeho funkcí stimulovat intracelulární pochody. Ve svalových buňkách je akční potenciál prvním krokem v řetězci událostí vedoucích ke stahu. V ß-buňkách slinivky podněcují sekreci inzulinu. Akční potenciály neuronů jsou známé také jako nervové impulzy.

Akční potenciály jsou vytvářeny speciálními typy napěťově řízených iontových kanálů, které jsou vnořené v membráně buňky. Tyto kanály jsou uzavřeny, když se hodnota membránového potenciálu pohybuje kolem klidové hodnoty. Otevírají se, když membránový potenciál dosáhne určité prahové hodnoty. Když se kanály otevřou (pokud dojde k depolarizaci v napětí membrány), tak jsou do buňky vpuštěny kationty sodíku, které změní elektrochemický gradient. To vede ke zvýšení hodnoty membránového potenciálu. To dále způsobí otevření dalších kanálů, což vytvoří vyšší elektrický impuls napříč membránou, a tak dále. Tento proces bouřlivě probíhá, dokud nejsou otevřeny všechny dostupné kanály. Výsledkem je obrovský vzrůst membránového potenciálu. Rapidní přítok sodných iontů obrátí polaritu (dojde k tzv. transpolarizaci) a iontové kanály se rychle uzavřou. Když se kanály pro sodík uzavřou, tak už ionty sodíku nemohou vnikat do neuronu a jsou aktivním transportem přemístěny vně buňky. Pak se aktivují kanály pro draslík, jenž začne proudit ven z buňky, a tím vrací membránový potenciál na původní hodnotu. Po vzniku AP dojde vlivem draselných iontů k přechodnému negativnímu posunu hodnoty membránového potenciálu, k tzv. refrakterní době, která následuje po hyperpolarizaci. Tento mechanismus brání tomu, aby se AP šířil zpět stejnou cestou, kterou původně dorazil. Výjimkou jsou vápenné kanálky, které zpětné šíření umožňují, tzv. neurální zpětná propagace.
V živočišných buňkách jsou dva hlavní druhy akčních potenciálů. Jeden typ je vyvolán kanály pro sodík a druhý kanály pro vápník. Mechanismus sodíku trvá méně než 1 milisekundu, zatímco mechanismus vápníku může trvat 100 milisekund i déle. U některých neuronů slouží pomalé mechanismy vápníku jako hnací síla pro déletrvající mechanismy sodíku. Na druhou stranu, u buněk srdečního svalu je to přesně naopak.
Téměř všechny buněčné membrány živočichů, rostlin a hub udržují rozdíl napětí mezi vnitřním prostředím buňky a vnějším prostředím. Napětí se v těchto případech měří v milivoltech (mV). Běžné napětí napříč membránou živočišné buňky je přibližně -65 mV. Díky velmi malé tloušťce buněčné membrány vytváří již tyto hodnoty napětí velmi silné elektrické síly v okolí membrány.
Ve většině buněk bývá napětí téměř vždy stálé. Existují však typy buněk, které jsou elektricky aktivní a jejich napětí se mění. V některých může napětí výrazně vzrůstat a klesat na určité stálé hodnoty. Tyto cykly klesání a vzrůstání napětí se nazývají akční potenciály. Trvání AP se může velmi různit, v důsledku toho jsou to vlastně analogové signály. V mozkových buňkách živočichů může celý cyklus proběhnout za méně než tisícinu sekundy. V jiných typech buněk může trvat i několik sekund.
Elektrické vlastnosti živočišné buňky jsou určeny strukturou membrány, která ji obklopuje. Buněčná membrána se skládá z dvojité vrstvy lipidů, ve které jsou zakotveny větší molekuly proteinů. Lipidová vrstva je velmi odolná vůči průchodu elektricky nabitých iontů, takže funguje jako izolant. Naproti tomu molekuly proteinů vytváří v membráně kanály, kterými mohou proudit ionty. Některé molekuly dokonce mohou určité ionty aktivně přenášet z jedné strany membrány na druhou.

Všechny buňky v tkáních těl živočichů jsou polarizované. Udržují rozdíl napětí napříč membránou, tzv. membránový potenciál. Polarizace je výsledkem komplexní souhry mezi membránovými strukturami proteinů, neboli iontovými pumpami, a iontovými kanály. V neuronu se iontové kanály vyskytují v různých částech buňky, což zajišťuje různé vlastnosti dendritů, axonů a těla buňky. Výsledkem toho jsou určité části membrány vzrušivé (schopné vytvářet akční potenciál), zatímco ostatní ne. Za nejvíce vzrušivou část neuronu se současně považuje tzv. iniciální segment (místo, kde axon opouští tělo neuronu). Axon a buněčné tělo bývají většinou také vzrušivé.
Každá vzrušivá část membrány má dvě důležité hodnoty membránového potenciálu: klidový potenciál, což je hodnota membránového potenciálu po dobu, kdy buňku nic nerozrušuje, a vyšší hodnotu, zvanou prahový potenciál. Na iniciálním segmentu neuronu je hodnota klidového potenciálu asi -70 mV a prahového -55 mV. Excitační postsynaptický potenciál, resp.inhibiční postsynaptický potenciál z dendritů neuronu způsobují na membráně depolarizaci, resp.hyperpolarizaci. Tedy zvyšují, či snižují membránový potenciál. Akční potenciál vzniká při dostatečně velké depolarizaci, která zvýší membránový potenciál na hodnotu prahového potenciálu. Když vznikne AP, tak hodnota membránového potenciálu doslova "vystřelí" až k hodnotám kolem +100 mV. Pak stejně rychle klesá, většinou až pod prahovou hodnotu, kde nějakou chvíli zůstane. Tento průběh bývá stále stejný. Výchylky při stoupání a klesání hodnoty potenciálu jsou u jedné buňky stejné, stejně tak trvání tohoto procesu. Jak již bylo řečeno, proces trvá většinou v tisícinách sekundy. Mnoho druhů neuronů tvoří AP konstantně 10× až 100× za sekundu. Některé typy jsou však méně aktivní a mezi jednotlivými AP mohou být prodlevy v délce několika minut.

Akční potenciál vzniká díky přítomnosti speciálních napěťově řízených iontových kanálů v membráně. Napěťově řízený iontový kanál je shluk proteinů, který má tři klíčové vlastnosti:
Tyto kanály mají tudíž tendenci otevírat se a zavírat při určitých hodnotách membránového potenciálu. Většinou je však vztah mezi potenciálem a stavem kanálu jen pravděpodobnostní a zahrnuje časovou prodlevu. Iontové kanály mění konformace v nepředvídatelnou dobu. Membránový potenciál určuje rychlost a pravděpodobnost každého typu přechodu za jednotku času.
Napěťově řízené iontové kanály dokáží vytvářet AP, protože dávají vzniknout smyčce pozitivní zpětné vazby. Membránový potenciál ovládá stav kanálů, ale kanály zároveň ovládají membránový potenciál. Takže zvýšení membránového potenciálu může vyvolat otevření iontových kanálů, což vede k dalšímu zvýšení jeho hodnoty. Akční potenciál se objevuje, když tento cyklus pozitivní zpětné vazby probíhá výbušně. Čas a amplituda AP jsou určeny biofyzikálními vlastnostmi napěťově řízených iontových kanálů, které jej vytvářejí. Existuje několik typů kanálů, schopných vytvářet pozitivní zpětnou vazbu, která je nutná k vytvoření AP.
Sodné kanály jsou zodpovědné za rychlé akční potenciály v nervových drahách. Pomalejší akční potenciály ve svalových buňkách a dalších neuronech jsou vyvolány kanály pro vápník. Všechny tyto typy existují v několika variantách, přičemž se liší v citlivosti na napětí a časovou dynamikou.
Nejprostudovanější jsou sodné kanály v rychlých nervových drahách. Jsou známé také jako Hodgkin-Huxleyovy sodné kanály, protože byly poprvé popsány Alanem Hodgkinem a Andrewem Huxleym v Nobelovou cenou ohodnocené studii biofyziky akčního potenciálu. Známější jsou jako NaV kanály. ("V" označuje napětí – "voltage"). NaV kanály se mohou nacházet ve třech stavech. Deaktivované, aktivované a neaktivní. Kanály jsou pro sodné ionty propustné pouze v aktivovaném stavu. Při nízké hodnotě membránového potenciálu je kanál většinou v deaktivovaném stavu (je uzavřený). Když se potenciál zvýší na určitou hodnotu, tak je vyšší pravděpodobnost, že přejde do aktivního stavu (otevřený). Čím vyšší je membránový potenciál, tím vyšší je šance na změnu stavu. Jak se kanál jednou aktivuje, tak nakonec přejde do neaktivního stavu (uzavřeného). Kanál je po nějakou dobu neaktivní, ale stačí malé zvýšení potenciálu, a kanál přejde do deaktivovaného stavu. Většinou při vzniku AP probíhá tento cyklus: deaktivovaný → aktivovaný → neaktivní → deaktivovaný. Tohle je jen průměrné chování v populaci. Ve skutečnosti může kanál teoreticky přejít kdykoliv do jakéhokoliv stavu. Avšak přechod z neaktivního přímo do aktivního stavu je velmi nepravděpodobný. Neaktivní kanál setrvává ve svém stavu, dokud nepřejde do deaktivovaného.
Výsledkem toho všeho je, že kinetika NaV kanálů je určena pravděpodobnostní maticí, jejíž hodnoty složitě závisí na napětí. Jelikož tyto kanály hrají hlavní roli při určování napětí, tak je velmi obtížné určit celkovou dynamiku systému. Hodgkin a Huxley řešili problém soustavou diferenciálních rovnic, pro parametry, které řídí stavy iontových kanálů, známých jako Hodgkinovi-Huxleovy rovnice. Tyto rovnice byly důsledkem dalších výzkumů výrazně upraveny, ale staly se základem všech teoretických studií akčního potenciálu v biofyzice.
Když se zvýší membránový potenciál, tak se otevřou iontové kanály pro sodík a umožní iontům sodíku vstoupit do buňky. Následuje otevření kanálů pro draslík, což umožní iontům draslíku opustit buňku. Přítok sodných iontů zvyšuje koncentraci kationtů uvnitř buňky a způsobuje depolarizaci, a membránový potenciál je tedy vyšší než klidový. Kanály sodíku se uzavřou při vrcholu AP, zatímco draselné ionty dále proudí ven. Přesun draselných iontů ven snižuje membránový potenciál a vede k hyperpolarizaci. Když se napětí zvýší jen o malou hodnotu oproti klidovému potenciálu, tak proud draslíku převýší proud sodíku a hodnota napětí se vrací ke klidové hodnotě, většinou -70 mV. Pokud však zvýšení napětí překročí určitou kritickou mez, většinou o 15 mV více, než je klidová hodnota, tak převládne proud sodíku. Toto vede ke vzniku pozitivní zpětné vazby, která aktivuje ještě více sodných kanálů. Buňka pak doslova vystřeluje jeden AP za druhým.
Vzruchy vytvořené otevřením napěťově řízených kanálů u akčního potenciálu, jsou většinou výrazně větší než počáteční stimulační vzruchy. Amplituda, trvání a tvar AP jsou určeny především vlastnostmi membrány, a ne amplitudou nebo trváním stimulu. Vlastnost "vše nebo nic" odlišuje AP od synaptických, elektrotonických a receptorových potenciálů, které se řídí velikostí stimulu. Různé AP existují v mnoha typech buněk a jejich částech, které se různí typem kanálů, jejich rozdělením, koncentrací iontů, kapacitou membrány, teplotou atd.
Hlavní ionty, které se účastní vzniku AP jsou sodné a draselné ionty. Sodné vstupují do buňky a draselné z buňky. Tak je udržována rovnováha. Stačí přesun jen malého počtu iontů, aby se napětí membrány drasticky změnilo. Ionty přesunuté během AP vytváří jen nepatrnou změnu v koncentraci. Těch pár iontů, které se přesunou, je vtaženo zpět díky neustálé aktivitě sodíko-draslíkové pumpy, která spolu s dalšími přenašeči iontů udržuje konstantní poměr koncentrací iontů kolem membrány. Vápenaté a chloridové ionty se účastní jen několika typů AP, jako třeba srdečního AP nebo AP u řas rodu Acetabularia.
Přestože jsou AP vytvářeny v určitých částech membrány, tak výsledné vzruchy mohou spustit AP na sousedních úsecích membrány. Jeho šíření pak funguje jako domino. Oproti pasivně šířeným elektrickým potenciálům jsou AP znovuvytvářeny ve vzrušivých částech membrány a šíří se plynule. Myelinizované části axonů nejsou vzrušivé a AP se tedy přenáší pasivně jako elektrický potenciál. Pravidelně se vyskytující nemyelinizované části – Ranvierovy zářezy šíření AP zesilují. Tento typ šíření, zvaný jako "saltatorické (skákavé) šíření", poskytuje výhodný kompromis mezi rychlostí signálu a průměrem axonu.
Předtím, než budeme uvažovat o tom, jak se AP šíří po axonech a co se děje v synapsích, tak je důležité poznat způsoby, kterými může AP v iniciačním segmentu vznikat. Základním požadavkem je zvýšení membránového potenciálu na iniciačním segmentu nad prahovou hodnotu. Existuje několik způsobů, jak depolarizace vzniká.
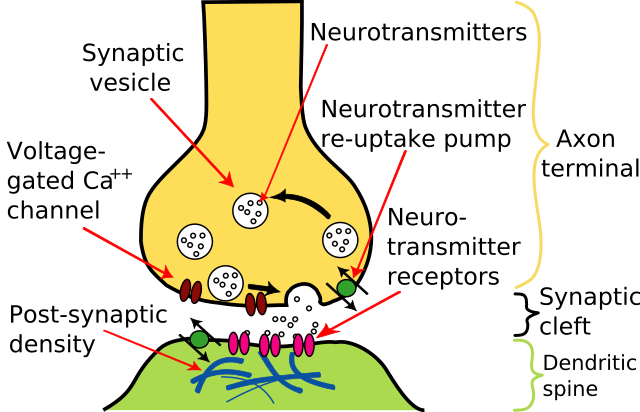
AP jsou většinou iniciovány excitačními postsynaptickými potenciály z presynaptických neuronů. Ty uvolňují molekuly neurotransmiteru, které se následně navážou na receptory postsynaptické buňky. Tato vazba způsobuje otevření iontových kanálů. To má další vliv na propustnost membrány buňky a tedy i na změnu membránového potenciálu. Pokud vazba zvýší napětí (depolarizuje membránu), tak se synapse stane vodivou. Pokud ale vazba sníží napětí (hyperpolarizace), tak dojde k inhibici.
Ať je napětí změněno jakkoliv, tak změny se pasivně přenáší do okolních částí membrány (jak popisuje teorie kabelu). Síla napěťového stimulu klesá exponenciálně se vzdáleností od synapse a časem navázání neurotransmiteru. Zlomky tohoto excitačního napětí mohou dojít až k iniciálnímu segmentu a výjimečně mohou dostatečně depolarizovat membránu, aby vznikl AP. Většinou ale musí několik excitačních potenciálů z různých synapsí pracovat společně skoro ve stejnou chvíli, aby dokázaly vybudit vznik nového AP. Jejich společná snaha však může být zmařena protichůdnými inhibičními postsynaptickými potenciály.
Neurotransmitery mohou projít i přes elektrické synapse. Díky přímému spojení dvou vzrušivých buněk pomocí tzv. gap junctions (nexů) může být AP obousměrně přenesen přímo z jedné buňky do druhé. Volný tok iontů mezi buňkami vyvolá rapidní ne-chemicky zprostředkovanou transmisi. Usměrňovací kanály zajišťují, že AP bude elektrickou synapsí procházet je jedním směrem. Elektrické se nachází ve všech nervových soustavách, včetně lidského mozku, i když jen v malém množství.
Amplituda akčního potenciálu je nezávislá na počtu impulzů, které jej vyvolaly. Jinými slovy, větší proud neznamená větší AP. Akční potenciály jsou signály "vše nebo nic", což znamená, že buď se vytvoří, nebo vůbec ne. Nic mezi tím. Oproti tomu receptorové potenciály mohou mít různou amplitudu závislou na intenzitě stimulu.
Průběh AP lze rozdělit do 5 fází: fáze růstu, fáze vrcholu, fáze poklesu, fáze propadu (podkmitu) a hyperpolarizace. Během fáze růstu dojde k depolarizaci membrány (stane se kladnější). Chvíle, kdy se depolarizace zastaví se nazývá vrcholná fáze. Membránový potenciál dosáhne svého maxima. Pak následuje fáze poklesu. Dochází k postupné repolarizaci membrány (stává se zápornější). Fáze propadu je moment, kdy hodnota membránového potenciálu dočasně klesne až pod úroveň původní klidové hodnoty (hyperpolarizace). Nakonec, chvíle, kdy nelze vytvořit další AP se nazývá refrakterní perioda a může se s ostatními fázemi překrývat.
Průběh AP je určen dvěma společnými efekty. Zaprvé, iontové kanály citlivé na napětí, se zavírají a otevírají, jako odpověď na změny membránového napětí Vm. To změní propustnost membrány pro tyto ionty. Zadruhé, dle Goldmannovy rovnice, tato změna propustnosti znamená změnu elektrochemického rovnovážného potenciálu Em, a tedy změnu membránového napětí Vm. Takže membránový potenciál ovlivňuje propustnost, která dále ovlivňuje membránový potenciál. Toto umožňuje vznik pozitivní zpětné vazby, která je klíčovou částí ve fázi růstu AP. Komplikovaným faktorem je, že jednotlivé iontové kanály mohou mít více vnitřních "průchodů", které reagují na změny Vm opačnými způsoby, nebo jinou měrou. Například, přestože zvýšení Vm otevře většinu průchodů v iontových kanálech pro sodík, také dojde k uzavření "deaktivačního průchodu" daného kanálu, ačkoli pomaleji. Když tedy dojde k prudkému zvýšení Vm, tak se sodné kanály zprvu otevřou, ale pak se zavřou vlivem pomalejší deaktivace.
Hodnoty napětí a proudu AP ve všech jeho fázích byly přesně namodelovány Alanem Lloydem Hodgkinem a Andrewem Huxleym v roce 1952. Za to v roce 1963 obdrželi Nobelovu cenu za fyziologii a medicínu. Jejich model však popisuje pouze dva typy iontových kanálů, přičemž vychází z různých předpokladů, jako například, že jejich vnitřní průchody se otevírají a zavírají nezávisle na sobě. Ve skutečnosti existuje více druhů iontových kanálů a ne vždy se chovají nezávisle.
AP obvykle vzniká na v iniciálním segmentu, vlivem silné depolarizace, tedy stimulem, který zvýší Vm. Depolarizace je vyvolána přítokem sodných kationtů do buňky. Tyto kationty mohou přijít z několika zdrojů (synapse, smyslové neurony).
U neuronu je v klidovém stavu v extracelulární tekutině vysoká koncentrace iontů chloru a sodíku v porovnání s vnitřkem buňky, zatímco uvnitř buňky je vysoká koncentrace iontů draslíku oproti mimobuněčné tekutině. Tento koncentrační gradient, společně s draselnými kanály v membráně neuronu, způsobí odtok draselných iontů a klidový potenciál se blíží hodnotě -75mV. Depolarizace otevře kanály sodíku i draslíku, což umožní obousměrný tok iontů v axonu. Pokud je depolarizace malá (-70mv až -60mV), tak odtok iontů draslíku převládne nad přítokem iontů sodíku a membrána se repolarizuje zpět na klidovou hodnotu kolem -70mV. Když je však depolarizace dostatečná, tak se zvýší proud sodných iontů do buňky a převládne nad draselným. Díky pozitivní vazbě platí: větší přísun iontů znamená větší rozdíl Vm, což dále vede k většímu přísunu. Dostatečná depolarizace (zvýšení Vm) způsobí otevření napěťově řízených kanálů sodíku, zvyšující se propustnost membrány směřuje k hodnotě rovnoměrného napětí sodíku (ENa = +55mV). Zvyšující se napětí otevírá ještě více kanálů sodíku, což sune hodnotu Vm stále blíže ENa. Prudký vzrůst Vm a propustnosti pro sodík odpovídá fázi růstu AP.
Kritická hodnota pro tento děj je obvykle asi -45mV, ale závisí to na předchozí aktivitě axonu. Membrána, která právě vytvořila AP nemůže ihned vytvořit další, protože iontové kanály se ještě nevrátily do deaktivovaného stavu. Doba, po kterou nemůže být vytvořen nový AP se nazývá absolutní refrakterní perioda. Po delší době, kdy se část kanálů obnoví, může vzniknout další AP, ale prahová hodnota je vyšší a musí tak dojít k mnohem silnější depolarizaci (až -30mV). Doba, po kterou je obtížnější vytvořit AP se nazývá relativní refrakterní perioda.
Pozitivní zpětná vazba se v průběhu fáze růstu zpomaluje, a když se kanály sodíku maximálně otevřou, tak se nakonec zastaví. Při vrcholu AP je propustnost pro sodík maximální a membránové napětí Vm je téměř na hodnotě rovnoměrného napětí ENa. Vzrůst napětí, který původně otevřel kanály sodíku, je také pomalu uzavírá. Kanály se stanou neaktivními. To sníží propustnost pro sodík ve prospěch draslíku, což vede k poklesu membránového napětí zpět na klidovou hodnotu. Ve stejnou chvíli se otevřou kanály pro draslík, což vede ke zvýšení propustnosti pro draslík a hodnota membránového napětí míří k rovnovážné hodnotě draslíku EK. Kombinací těchto změn v propustnosti pro sodík a draslík se hodnota Vm rychle sníží, dojde k repolarizaci membrány, a tedy k fázi poklesu AP.
Zvýšení napětí otevřelo mnohem více kanálů draslíku, než je obvyklé a některé z nich se nezavřou ihned v dobu, kdy se napětí membrány vrací do klidové hodnoty. Navíc se další kanály draslíku otevírají jako odpověď na přítok iontů vápníku během AP. Propustnost membrány pro draslík je dočasně velmi vysoká, což posouvá hodnotu Vm blíže k rovnovážné hodnotě draslíku EK. Následuje tedy podkmit, neboli hyperpolarizace. (Hodnota KMP se tedy dostává ještě níže, než byla původní hodnota.) Ta trvá, dokud se propustnost pro draslík nevrátí do normálu.
Po každém AP následuje refrakterní doba. Dělí se na absolutní a relativní. Tyto dvě periody vznikají vlivem změn molekul sodných a draselných kanálů. Při uzavření po AP jsou kanály sodíku v neaktivním stavu, kdy je nelze otevřít, bez ohledu na membránový potenciál. Takto vzniká absolutní refrakterní perioda. I po tom, co se některé kanály vrátí do aktivního stavu, se často stává, že zlomek draselných kanálů zůstává otevřených, a je tedy obtížnější vyvolat depolarizaci. A tehdy se jedná o relativní refrakterní periodu. Protože se množství a podtypy draselných kanálů mohou velmi lišit u jednotlivých typů neuronů, tak bývá doba trvání relativní refrakterní periody dosti odlišná.
Absolutní refrakterní perioda se velkou měrou podílí na jednosměrném šíření AP na axonech. V daný moment je refrakterní segment ten, který se nachází za segmentem právě aktivním. Segment, který se nachází před ním však ještě nebyl aktivován a může být depolarizován akčním potenciálem.
AP vzniká na iniciačním segmentu a putuje po axonu jako vlna. Proudy, které jdou do určitých míst axonu se po něm šíří a depolarizují sousední membrány segmentů axonu, pokud je depolarizace dostatečně silná. Tento základní mechanismus představil v roce 1937 Alan Hodgkin. Po zničení nebo ochlazení segmentů axonu a tedy zablokování AP ukázal, že AP na jedné straně dokáže vytvořit AP na druhé, pokud byl blokovaný segment dostatečně krátký.
Při klasickém ortodromickém vedení putuje AP od iniciálního segmentu k terminálnímu butonu. Vedení v opačném směru, tzv. antidromické, je velmi vzácné. Avšak pokud je v laboratoři axon stimulován uprostřed, tak vzniknou dva AP, každý putující jedním směrem. Existují dvě cesty ke zvýšení rychlosti vedení, jednak zvětšení průměru axonů, které vede ke snížení axiálního odporu, což naráží u člověka na prostorová omezení (velikost hlavy), ale je přítomné u mořských bezobratlých živočichů (např. squid giant axon s průměrem 1 mm) a dále lepší izolace axonu (myelinizace) ke snížení membránové vodivosti a kapacitance , tj. zvyšuje membránový odpor a snižuje kapacitanci membrány (analogické sériovému zapojení mnoha kondenzátorů). Další funkcí izolace (myelinizace) je prevence efaptického přenosu („přeskakování“) AP z axonu na sousední vlákna) .

Aby byl elektrických signál přenášen rychleji, tak jsou některé axony obaleny myelinovou pochvou. Myelin tvoří vícevrstvé membrány, které obalují části axonu a rozdělují jej tzv. Ranvierovými zářezy na segmenty. Myelin je tvořen Schwannovými buňkami (PNS), nebo oligodendrocyty (CNS). Myelin snižuje kapacitu a zvyšuje odpor membrány, takže signál putuje rychleji. Myelinizované axony se vyskytují především u obratlovců. Ale ne u všech neuronů je přítomna myelinová pochva. Např. axony postgangliových neuronů autonomního nervového systému většinou nejsou myelinizované.
Myelin také zabraňuje pohybu iontů. Myelin obecně zvyšuje rychlost vedení AP a přenos je tak efektivnější. Rychlost může být 1-100 m/s, přičemž větší průměr axonu znamená vyšší rychlost. AP nemohou putovat po membráně v myelinizovaných úsecích axonu. Proud však putuje cytoplazmou, která je schopna depolarizovat 1 až 2 následující Ranvierovy zářezy. Proud iontů z AP na jednom zářezu vytvoří další AP na následujícím zářezu. Toto zjevné "hopsání" akčního potenciálu ze zářezu do zářezu se nazývá saltatorické šíření. Poprvé s touto myšlenkou přišel Ralph Lillie, ale experimentálně ji dokázali až Ichiji Tasaki a Taiji Takeuch, a také Andrew Huxley a Robert Stämpfli. U nemyelinizovaných axonů se AP přenáší po membráně a šíří se kontinuálně jako vlna.

Myelin má dvě hlavní výhody: rychlost přenosu a energetická výhodnost. U axonů s minimálním průměrem (asi 1 mikrometr) myelin zvyšuje rychlost desetinásobně. Naopak myelinová vlákna jsou menší než nemyelinizovaná. Například, akční potenciály se v myelinizovaných i nemyelinizovaných axonech žáby šíří zhruba stejnou rychlostí, asi 25m/s. Ale žabí axon má asi třicetkrát menší průměr a tisíckrát menší plochu průřezu. Pokud jsou ionty hromaděny v Ranvierových zářezech, tak projde membránou mnohem méně iontů, což šetří energii. To je velmi výhodné, jelikož nervový systém člověka využívá asi 20% energie metabolismu.
Délka myelinizovaných segmentů je důležitá pro úspěšné saltatorické šíření. Měly by být co nejdelší, aby byla maximalizována rychlost, ale ne tak dlouhé, aby byl signál příliš slabý. V přírodě jsou většinou axony dost dlouhé na to, aby přenesly signál minimálně přes dva zářezy. Faktor bezpečnosti saltatorického šíření je tedy vysoký, umožňující obejít přenos přes zářezy v případě zranění. AP může skončit předčasně v místech s nízkým faktorem bezpečnosti. Příkladem je místo, kde se axon různě větví.
Některé choroby ničí myelin a narušují saltatorické šíření, a tedy snižují rychlost přenosu AP. Nejznámější je roztroušená skleróza, kde degradací myelinu dochází k problémům s koordinací.

Tok proudu v axonech lze kvantitativně popsat teorií kabelu a jejím zpracováním, jako je například komparmentový model. Tuto teorii vytvořil v roce 1855 Lord Kelvin, aby vytvořil model transatlantického telegrafního kabelu. V roce 1946 Hodgkin a Rushton ukázali, že tento model je podobný pro neurony. V zjednodušené teorii je neuron považován za elektricky neutrální a dokonale propustný kabel, který lze popsat parciální diferenciální rovnicí,
kde V(x,t) je napětí membrány v čase t a na pozici x podél neuronu, a kde jsou lambda a tau () charakteristické škály délky a času, dle kterých se napětí poklesne reakcí na stimul. Dle schématu obvodu na obrázku lze tyto škály určit z odporu a kapacity na jednotku délky.
Z těchto škál lze odvodit závislost rychlosti vzruchu na průměru neuronu v nemyelinizovaných vláknech. Například časová škála t se zvyšuje s odporem i kapacitou membrány. Když se zvýší kapacita, tak musí být převeden větší náboj, aby vzniklo odpovídající napětí (dle rovnice Q=CV). Když se zvýší odpor, tak je za jednotku času přenesen menší náboj, což zpomaluje vyrovnání. A podobně, když je vnitřní odpor v závislosti na jednotce délky nižší v jednom axonu oproti druhému (protože poloměr původního je větší). Prostorová délka útlumu lambda se prodlužuje a rychlost AP by se měla zvětšovat. Pokud se zvýší vnitřní odpor membrány rm, tak se sníží průměrný "průchod" proudu membránou, což rovněž vede k prodloužení lambda a zvýšení rychlosti.
Akční potenciál, který dosáhne terminálního butonu způsobí uvolnění neurotransmiteru do synaptické štěrbiny. Neurotransmitery jsou malé molekuly, které mohou otevřít iontové kanály v postsynaptické buňce. S příchodem AP se v presynaptické membráně otevřou napěťově řízené iontové kanály pro vápník. Přísun vápenatých iontů způsobí pohyb vezikulů s neurotransmiterem na povrch buňky, kde uvolní svůj obsah do synaptické štěrbiny. Tento komplexní proces je inhibován neurotoxinem tetanospasminem a botulinum toxinem, jež způsobují tetanus a botulismus.

AP může být přenášen i mezibuněčnými spoji, jako třeba gap junctions (nexy). Iontový proud může tedy přímo stimulovat postsynaptickou buňku. Tento způsob je rychlejší, protože není třeba pomalé difuze neurotransmiterů skrz štěrbinu. Tyto synapse se používají, když je třeba okamžitá reakce a časová koordinace je kritická, například při únikových reflexech, v sítnici obratlovců, v srdci.

Tento AP se liší tím, že trvá mnohem déle, fáze vrcholu na grafu připomíná plošinu (plató). Membrána je po delší dobu držena na vysoké hodnotě napětí, dokud nedojde k poklesu tokem iontů draslíku, jako obvykle. Tento delší průběh je způsoben pomalejším otevíráním vápenatých kanálů, které si udržují rovnovážnou hodnotu i po tom, co byly deaktivovány sodné kanály.
Srdeční akční potenciál hraje důležitou roli při koordinaci stahů srdce. Buňky sinoatriálního uzlu (SA uzel, srdeční pacemaker) rytmicky vytváří akční potenciál (vzruch), který se postupně šíří po srdci a vyvolává jeho stahy. Vzruch nejprve putuje síněmi do atrioventrikulárního uzlu (AV uzel). Následně prochází přes Hisův svazek, který je běžně jediným vodivým spojením mezi síněmi a komorami. Ten se v oblasti komor rozděluje na Tawarova raménka (pravé a levé), na něž navazují Purkyňova vlákna. Poruchy vzniku a šíření srdečního AP označujeme jako arytmie či dysrytmie. Vznik a šíření vzruchu ovlivňuje celá řada léků, vliv má i působení nervové soustavy, obsah minerálů v krvi či například některé přírodní látky.
Je podobný jako AP neuronů. AP je výsledkem depolarizace membrány (sarkolemy), otevřou se sodné kanály, které jsou pak deaktivovány a dojde k repolarizaci a toku draselných iontů ven. Klidový potenciál bývá kolem -90 mV, tedy o něco nižší než u neuronů. AP trvá asi 2-4 ms, absolutní refrakterní perioda trvá 1-3 ms a rychlost šíření je asi 5 m/s. AP uvolní vápenaté ionty, které uvolní tropomyozin a umožní kontrakci svalu. AP vznikají v nervosvalové ploténce, která je častým terčem neurotoxinů.
Buňky rostlin a hub jsou také vzrušivé. Hlavní rozdíl je v tom, že depolarizace není vyvolána zvýšením počtu sodných iontů, ale uvolněním aniontů chloru. Společně s následným uvolněním draselných iontů, jejichž role je společná i u zvířat, AP vyvolá rozdíl v osmotickém tlaku (KCl), zatímco u zvířat je osmotický tlak neutrální. Tlak je vyrovnán přesunem draselných i chloridových iontů. Vztah mezi osmózou a elektřinou v rostlinných buňkách svědčí o společné funkci osmózy a elektrické vzrušivosti, při změnách podmínek slanosti u jednobuněčných předků rostlin a zvířat, zatímco současná funkce rychlého přenosu signálu je viděna jako mladší úspěch živočišných buněk v stabilnějším osmotickém prostředí. Je třeba předpokládat, že podobná signalizační funkce AP u některých cévnatých rostlin (Mimosa pudica) se vyvinula nezávisle na živočišných vzrušivých buňkách.
Akční potenciály se nacházejí v mnohobuněčných organizmech, včetně rostlin, hmyzu, obratlovců, plazů a savců. Houby se zdají být hlavním kmenem mnohobuněčných eukaryot, který nemá AP, přestože některé studie navrhují, že mají také systém elektrického signálu. Klidový potenciál, stejně jako velikost a trvání AP se evolucí moc nezměnil, ale rychlost se dramaticky liší dle průměru a myelinizace.
| Tvor | Typ buněk | Klidový potenciál (mV) | Zvýšení AP (mV) | Trvání AP (ms) | Rychlost vedení (m/s) |
|---|---|---|---|---|---|
| Chobotnice | Obří axon | −60 | 120 | 0.75 | 35 |
| Žížala | Střední velké vlákno | −70 | 100 | 1.0 | 30 |
| Šváb | Velké vlákno | −70 | 80–104 | 0.4 | 10 |
| Žába | Axon sedacího nervu | −60 až −80 | 110–130 | 1.0 | 7–30 |
| Kočka | Míšní motorický neuron | −55 až −80 | 80–110 | 1–1.5 | 30–120 |
Díky své neměnnosti během evoluce se zdá, že AP disponuje evolučními výhodami. Jednou funkcí je rychlý signál tělem na velkou vzdálenost. Rychlost může vzrůst až na 110 m/s, což je třetina rychlosti zvuku. Pro porovnání, molekula hormonu putující krevní řečištěm se ve velkých tepnách pohybuje rychlostí asi 8 m/s. Částí této funkce je jemná koordinace mechanických dějů, jako je srdeční stah. Druhou funkcí je výpočet, společně s vytvářením. To, že je to signál "vše nebo nic" znamená, že nedochází k poklesu se zvětšující se vzdáleností, má tedy výhody jako digitální elektronika. Sjednocení dvou různých dendritických signálů na iniciálním segmentu, které vede až k vytvoření komplexního sledu AP je další formou výpočtu, který byl biologicky využit, aby vznikly centrální generátory vzorců a mohl být napodoben umělými nervovými sítěmi.

Studium AP si vyžádalo vývoj experimentálních metod. První pokusy, roku 1955, se zaměřovaly na tři cíle: izolace neuronů a axonů, výroba rychlé a citlivé elektroniky a zmenšení elektrod tak, aby se dalo změřit napětí jediné buňky.
První problém byl vyřešen studiem obřích axonů nalezených u neuronů chobotnice rodu Loligo. Tyto axony jsou tak velké v průměru (1mm, 100× více než normální), že je lze vidět pouhým okem, a lze je tedy snadno preparovat a manipulovat s nimi. Ale axony Loligo nejsou vzorem všech vzrušivých buněk. A byly studovány další systémy AP.
Druhý problém byl spojen s kritickým vývojem napěťových svorek, které umožnily výzkumníkům studovat izolovaně iontové proudy odpovídající AP a eliminovat elektronický šum. Proud IC, společně s kapacitou membrány (C). Jelikož se proud rovnal součinu C a napětí Vm, tak byl navržen obvod, který udržoval Vm na jedné hodnotě, bez ohledu na proud, který procházel membránou. A proud potřebný k udržení stejného napětí přímo odpovídá proudu v membráně. Další elektronické postupy využívají Faradayovy klece a elektroniku s vysokou hodnotou vstupní impedancí, tak aby měření neovlivnilo napětí.
Třetí problém s elektrodami byl vyřešen v roce 1949 vynálezem skleněných mikroelektrod, které se rychle dostaly do rukou vědcům. Tato metoda umožňuje vytvářet elektrody o velikosti 10nm, kterým je také udělena vysoká impedance. AP lze zaznamenat i pomocí malých kovových elektrod umístěných v blízkosti neuronu, s neuročipy obsahujícími EOSFET, nebo opticky pomocí barviv citlivých na Ca2+ ionty nebo napětí.

Zatímco skleněné mikroelektrody měří množství proudu procházející iontovými kanály, studium elektrických vlastností samotných kanálu bylo možné od roku 1970, s vynálezem "patch svorky" Erwinem Neherem a Bertem Sakmannem, kteří ze něj obdrželi Nobelovu cenu v roce 1991. Tento vynález ověřil, že kanály mají jasně dané stavy vodivosti (otevřené, zavřené a deaktivované).
Optické technologie se rozvíjí v posledních letech a měří se jimi AP, buď současným vícemístným snímáním, nebo ultra-prostorovým rozkladem. Pomocí barviv citlivých na napětí byly zaznamenány AP malé části membrány kardiomyocytu.

Některé neurotoxiny, přírodní i umělé, svou strukturou blokují AP. Tetrodotoxin čtverzubcovitých a saxitoxin blokují AP inhibicí sodíkový kanál, zatímco tetraetylammonium (TEA) blokuje draslíkové kanály. Podobně dendrotoxin mamby černé inhibuje draselné kanály. Tyto inhibitory iontových kanálů slouží jako důležité objekty výzkumu, protože vědcům umožňují "vypnout" určité kanály dle uvážení a izolovat ostatní kanály. Také jsou užitečné při čištění kanálů afinitní chromatografií nebo při stanovení jejich koncentrace. Jsou to ale efektivní neurotoxiny, a proto se uvažovalo o jejich použití jako chemických zbraní. Neurotoxiny zaměřené na iontové kanály hmyzu jsou efektivními insekticidy. Příkladem je syntetický permethrin, který prodlužuje aktivaci sodných kanálů při AP. Kanály hmyzu jsou značně odlišné od lidských, takže na člověka mají jen malý vedlejší účinek. Mnoho dalších neurotoxinů narušuje přenos AP v synapsích, zvláště v nervosvalové ploténce.

Role elektřiny v nervovém systému zvířat byla poprvé objevena u žab Luigim Galvanim, který ji studoval v letech 1791–1797. Galvaniho výsledky podnítily Alessandra Voltu, aby vyvinul Voltův sloup, první známou baterii, se kterou studoval elektřinu zvířat a fyziologické reakce na napětí stejnosměrného proudu.
Vědci 19. století studovali celkové vedení elektřiny v nervech a ukázali, že nervová tkáň je složena z buněk, místo z propojené sítě vláken (retikul). Carlo Matteucci následoval Galvaniho studie a ukázal, že membrány mají své napětí, a že mohou vytvářet elektrický proud. Jeho práce inspirovala německého fyziologa Emila du Bois-Reymonda, který v roce 1848 objevil AP. Vedení proudu AP bylo poprvé změřeno v roce 1850 Bois-Reymondovým přítelem Hermannem von Helmholtzem. Aby se ujistil, že tkáň je z buněk, tak španělský fyzik Santiago Ramón y Cajal a jeho studenti použili Golgiho barvicí metodu, aby odhalili rozličné tvary neuronů, jež pečlivě zaznamenali. Za jejich objevy byli Golgi a Ramón y Cajal odměněni Nobelovou cenou za fyziologii v roce 1906. Jejich práce vedla k dlouhodobým sporům v neuroanatomii v 19. století. Sám Golgi zastával síťový model nervového systému.
20. století bylo zlatou érou elektrofyziologie. V roce 1902 a pak 1912 Julius Bernstein zdokonalil myšlenku, že AP vznikají vlivem změn propustnosti membrány pro ionty. Jeho hypotéza byla potvrzena Kenem Colem a Howardem Curtisem, kteří ukázali, že vodivost membrány se během AP zvyšuje. V roce 1907 Louis Lapicque přišel s nápadem, že AP je generován při překročení prahové hodnoty, což by bylo později ukázáno jako důsledek vodivosti dynamického systému iontů. V roce 1949 Aland Hodgkin a Bernard Katz vylepšili Bernsteinovu hypotézu zjištěním, že propustnost membrány se může lišit pro jednotlivé ionty. V podstatě demonstrovali důležitou roli propustnosti pro sodné ionty. Udělali první záznam elektrických změn membrány, které zprostředkuje AP. Tento výzkum byl v roce 1952 sepsán do pěti Hodgkinových, Katzových a Huxleyových studií, ve kterých využili napěťových svorek pro určení závislosti propustnosti membrány pro sodné a draselné ionty na napětí a čase, z čehož byli schopni kvantitativně rekonstruovat AP. Hodgkin a Huxley porovnali vlastnosti matematického modelu s citlivými iontovými kanály v několika různých stavech. Jejich hypotézy byly potvrzeny mezi 70. a 80. lety 20. století Erwinem Neherem a Bertem Sakmannem, kteří vyvinuli způsob, jak rozpoznat jednotlivé stavy kanálů. V 21. století začínají vědci rozumět strukturálním základům těchto vodivých stavů a selektivitě kanálů pro ionty, díky znalosti krystalových struktur na úrovni atomů, fluorescenčních měření a kryoelektronové mikroskopie.
Julius Bernstein jako první představil Nernstovu rovnici pro klidový potenciál. Ta byla zobecněna Davidem Goldmanem do známé Goldmanovy rovnice v roce 1943. Sodíko-draslíková pumpa byla objevena v roce 1957 a její vlastnosti brzy po té, díky určení její atomové struktury rentgenovou krystalografií.

Matematické a počítačové modely jsou důležité pro porozumění AP a vytváření předpovědí, které mohou být testovány experimentálně, a jasně tak ověří pravdivost teorie. Nejdůležitější model je Hodgkinův a Huxleyův. Ten popisuje AP jako sadu čtyř diferenciálních rovnic. I když je to značně zjednodušení oproti skutečnosti, tak komplexnost modelu inspirovala další, ještě přesnější modely, např. Morris-Lecarův, FitzHugh-Nagumo. Tyto modely byly důsledně matematicky, počítačově i elektronicky zkoumány. Moderní výzkum se zaměřuje na větší a více integrované systémy, které propojí AP s dalšími částmi NS (dendrity, synapse), aby vědci mohli zkoumat nervové výpočty, reflexy apod.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.