Punt de fusió
temperatura a la qual un sòlid es torna líquid From Wikipedia, the free encyclopedia
El punt de fusió d'un material és la temperatura a la qual aquest material comença a canviar el seu estat de sòlid a líquid a una determinada pressió;[1] és a dir, és el punt en què les seves molècules adquireixen una mobilitat suficient per trencar els lligams elèctrics i s'escampen lliurement.
En química orgànica, la regla de Carnelley, establerta en 1882 per Thomas Carnelley, afirma que una simetria molecular elevada s'associa amb un alt punt de fusió,[2] basant-se en l'examen de 15.000 compostos químics. Un alt punt de fusió resulta d'un alt calor de fusió, una baixa entropia de fusió, o una combinació de tots dos. En les molècules altament simètriques la fase cristal·lina està densament poblada amb moltes interaccions intermoleculars eficients que ocasionen un canvi d'entalpia de fusió més alt en.
Quan considerem la temperatura del canvi invers, de líquid a sòlid, ens referim al "punt de congelació". A diferència del punt d'ebullició, el punt de fusió és independent de la pressió.[3]
Mesures del punt de fusió
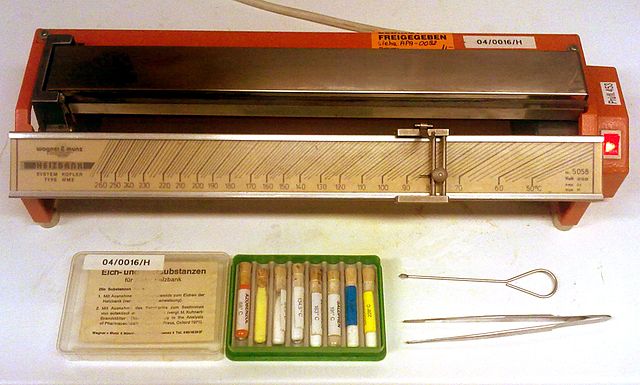
Hi ha moltes tècniques de laboratori per a la determinació de punts de fusió. Un banc Kofler és una tira de metall amb un gradient de temperatura (rang de temperatura ambient a 300°C). Es pot col·locar qualsevol substància en una secció de la tira, revelant-ne el comportament tèrmic a la temperatura en aquest punt. La calorimetria diferencial d'escombrada proporciona informació sobre el punt de fusió juntament amb la seva entalpia de fusió.

Un aparell de punt de fusió bàsic per a l'anàlisi de sòlids cristal·lins consisteix en un bany d'oli amb una finestra transparent (disseny més bàsic: un tub de Thiele) i una lupa simple. Es col·loquen diversos grans d'un sòlid en un tub de vidre prim i se submergeixen parcialment al bany d'oli. El bany d'oli s'escalfa (i s'agita) i amb l'ajuda de la lupa (i una font de llum externa) es pot observar la fusió dels vidres individuals a certa temperatura. Es pot fer servir un bloc de metall en lloc d'un bany d'oli. Alguns instruments moderns tenen detecció òptica automàtica.
El mesurament també es pot fer de forma contínua amb un procés operatiu. Per exemple, les refineries de petroli mesuren el punt de congelació del dièsel "en línia", cosa que significa que la mostra es pren del procés i es mesura automàticament. Això permet mesuraments més freqüents, ja que la mostra no s'ha de recol·lectar manualment i portar-se a un laboratori remot.
Tècniques per a materials refractaris
Per a materials refractaris (per exemple, platí, wolframi, tàntal, alguns carburs i nitrurs, etc.), el punt de fusió extremadament alt (generalment es considera que està per damunt de 1.800°C) es pot determinar escalfant el material en un forn de cos negre i mesurant la temperatura del cos negre amb un piròmetre òptic. Per als materials de més punt de fusió, això pot requerir una extrapolació de diversos centenars de graus. Se sap que la resplendor espectral d'un cos incandescent és funció de la temperatura. Un piròmetre òptic fa coincidir la resplendor d‟un cos en estudi amb la resplendor d‟una font que ha estat prèviament calibrada en funció de la temperatura. D'aquesta manera, el mesurament de la magnitud absoluta de la intensitat de la radiació és innecessària. No obstant això, cal utilitzar temperatures conegudes per determinar el calibratge del piròmetre. Per a temperatures per sobre del rang de calibratge de la font, cal emprar una tècnica d'extrapolació. Aquesta extrapolació s'aconsegueix utilitzant la llei de radiació de Planck. Les constants en aquesta equació no es coneixen amb prou precisió, cosa que fa que els errors en l'extrapolació siguin més grans a temperatures més altes. Tot i això, s'han desenvolupat tècniques estàndard per realitzar aquesta extrapolació.
Considereu el cas d'usar or com a font (mp = 1063°C). En aquesta tècnica, el corrent a través del filament del piròmetre s'ajusta fins que la intensitat de la llum del filament coincideix amb la d'un cos negre en el punt de fusió de l'or. Això estableix la temperatura de calibratge primària i es pot expressar en termes de corrent a través del llum de piròmetre. Amb el mateix ajustament actual, el piròmetre es veu en un altre cos negre a una temperatura més alta. S'insereix un medi absorbent de transmissió coneguda entre el piròmetre i aquest cos negre. A continuació, s'ajusta la temperatura del cos negre fins que hi hagi una coincidència entre la intensitat i la del filament del piròmetre. La vertadera temperatura més alta del cos negre es determina a partir de la Llei de Planck. Tot seguit, es retira el medi absorbent i s'ajusta el corrent a través del filament per fer coincidir la intensitat del filament amb la del cos negre. Això estableix un segon punt de calibratge per al piròmetre. Aquest pas es repeteix per portar el calibratge a temperatures més altes. Ara, es coneixen les temperatures i els corresponents corrents de filament piromètric i es pot traçar una corba de temperatura davant del corrent. Aquesta corba es pot extrapolar després a temperatures molt altes.
En determinar els punts de fusió d'una substància refractària mitjançant aquest mètode, cal tenir condicions de cos negre o conèixer l'emissivitat del material que s'està mesurant. La contenció del material d'alt punt de fusió en estat líquid pot introduir dificultats experimentals. Per tant, les temperatures de fusió d'alguns metalls refractaris s'han mesurat observant la radiació d'una cavitat de cos negre a mostres de metall sòlid que eren molt més llargues que amples. Per formar una cavitat d'aquest tipus, es perfora un orifici perpendicular a l'eix llarg al centre d'una vareta del material. Després, aquestes varetes s'escalfen passant un corrent molt gran a través seu, i la radiació emesa per l'orifici s'observa amb un piròmetre òptic. El punt de fusió està indicat per enfosquiment del forat quan apareix la fase líquida, destruint les condicions del cos negre. Avui dia, es fan servir tècniques d'escalfament per làser sense contenidors, combinades amb piròmetres i espectropiròmetres ràpids, per permetre un control precís del temps durant el qual la mostra es manté a temperatures extremes. Aquests experiments de durada inferior a un segon aborden diversos dels desafiaments associats amb els mesuraments més tradicionals del punt de fusió realitzats a temperatures molt altes, com ara la vaporització de la mostra i la reacció amb el recipient.
Termodinàmica

Perquè un sòlid es fongui, cal calor per elevar la seva temperatura fins al punt de fusió. No obstant això, cal subministrar més calor perquè tingui lloc la fusió: això s'anomena calor de fusió i és un exemple de calor latent.
Des d'un punt de vista termodinàmic, en el punt de fusió el canvi a l'energia lliure de Gibbs (ΔG) del material és zero, però l'entalpia (H) i l'entropia (S) del material augmenten (ΔH, ΔS> 0). El fenomen de fusió passa quan l'energia lliure de Gibbs del líquid es torna més baixa que la del sòlid per a aquest material. A diverses pressions, això passa a una temperatura específica. També es pot demostrar que:
Aquí T, ΔS i ΔH són respectivament la temperatura al punt de fusió, el canvi d'entropia de fusió i el canvi d'entalpia de fusió.
El punt de fusió és sensible a canvis de pressió extremadament grans, però generalment aquesta sensibilitat és ordres de magnitud menor que la del punt d'ebullició, perquè la transició sòlid-líquid representa només un petit canvi de volum.[4][5] Si, com s'observa a la majoria dels casos, una substància és més densa en estat sòlid que en estat líquid, el punt de fusió augmentarà en augmentar la pressió. En cas contrari, es produeix el comportament invers. Cal destacar que aquest és el cas de l'aigua, com s'il·lustra gràficament a la dreta, però també de Si, Ge, Ga, Bi. Amb canvis de pressió extremadament grans, s'observen canvis substancials al punt de fusió. Per exemple, el punt de fusió del silici a pressió ambient (0,1 MPa) és 1.415 °C, però a pressions superiors a 10 GPa disminueix a 1.000 °C.[3]
Els punts de fusió s'utilitzen sovint per caracteritzar compostos orgànics i inorgànics i per determinar-ne la seva puresa. El punt de fusió d‟una substància pura és sempre més alt i té un interval menor que el punt de fusió d‟una substància impura o, més generalment, de barreges. Com més gran sigui la quantitat d'altres components, menor serà el punt de fusió i més ampli serà l'interval del punt de fusió, sovint anomenat "interval pastós". La temperatura a què comença la fusió d'una barreja es coneix com a "solidus", mentre que la temperatura a què es completa la fusió s'anomena "liquidus". Els eutèctics són tipus especials de barreges que es comporten com a fases úniques. Es fonen bruscament a temperatura constant per formar un líquid de la mateixa composició. Alternativament, en refredar un líquid amb la composició eutèctica se solidificarà com a vidres mixtos petits (de gra fi) uniformement dispersos amb la mateixa composició.
A diferència dels sòlids cristal·lins, els vidres no posseeixen un punt de fusió; en escalfar-los, experimenten una suau transició vítria a un líquid viscós. En seguir escalfant-se, s'estoven gradualment, la qual cosa pot caracteritzar-se per certs punts d'estovament.
Depressió del punt de congelació
El punt de congelació d'un solvent disminueix quan s'afegeix un altre compost, el que significa que una solució té un punt de congelació més baix que un solvent pur. Aquest fenomen s'utilitza en aplicacions tècniques per evitar la congelació, per exemple, afegint sal o etilenglicol a l'aigua.
Regla de Carnelley
En química orgànica, la regla de Carnelley, establerta el 1882 per Thomas Carnelley, estableix que l′alta simetria molecular està associada amb un alt punt de fusió.[2] Carnelley va basar la seva regla a l'examen de 15.000 compostos químics. Per exemple, per a tres isòmers estructurals amb fórmula molecular C5H12 el punt de fusió augmenta a la sèrie isopentà −160 °C (113 K) n-pentà −129,8 °C (143 K) i neopentà −16,4 °C (256,8 K).[6] Així mateix, en els xilens i també en els diclorobenzens, el punt de fusió augmenta en l'ordre metà, orto i para. La piridina té una simetria més baixa que el benzè, per tant, el seu punt de fusió més baix, però el punt de fusió augmenta novament amb diazina i triazines. Molts compostos similars a gàbies com l'adamantà i el cubà amb alta simetria tenen punts de fusió relativament alts.
Un alt punt de fusió resulta d'un alt calor de fusió, una baixa entropia de fusió o una combinació de tots dos. En molècules altament simètriques, la fase cristal·lina està densament empaquetada amb moltes interaccions intermoleculars eficients que donen com a resultat un major canvi d'entalpia a la fusió.

Predicció del punt de fusió
Al febrer de 2011, Alfa Aesar va publicar més de 10.000 punts de fusió de compostos del seu catàleg com a dades obertes. Aquest conjunt de dades s'ha utilitzat per crear un model forestal aleatori per a la predicció del punt de fusió que ara està disponible gratuïtament.[8] Les dades obertes del punt de fusió també estan disponibles a Nature Precedings.[9] Tetko et al. van publicar dades d'alta qualitat extretes de patents i també models desenvolupats amb aquestes dades.[10][11]
Exemples
Referències
Vegeu també
Wikiwand - on
Seamless Wikipedia browsing. On steroids.

