Limfòcit T
From Wikipedia, the free encyclopedia
Els limfòcits T, també anomenats cèl·lules T, s'activen quan el receptor T és activat pels limfòcits B. Són cèl·lules centrals en la funció i regulació del sistema immunitari adaptatiu o cel·lular dels vertebrats. Aquests ataquen i destrueixen cèl·lules pròpies tumorals o infectades. A més de tenir funcions directes, com la citotoxicitat o la citòlisi, regulen el funcionament del seu propi llinatge i el d'altres mitjançant contactes cel·lulars i mediadors solubles, denominats citocines. Els limfòcits T que provenen de les cèl·lules mare s'originen a la medul·la òssia i d'allà passen al tim, on maduren. És per aquesta raó, que se’ls anomena limfòcits T.

Tipus
Els limfòcits els podem classificar segons els receptors presents en la seva membrana. Per tant, podem trobar limfòcits Tαβ i Tγδ. Els primers són els més estudiats i els que estan més presents en els humans. Es poden subdividir en citotòxics (Tc) o cooperadors (helpers o Th).
- Limfòcits Tc: en la seva membrana s'hi troben els coreceptors CD8. Els Tc detecten els pèptids presentats per l'MHC de classe I. La seva principal funció és la lisi de cèl·lules que presenten pèptids estranys en l'organisme.
- Limfòcits Th: en aquest cas, expressen en les seves membranes la molècula CD4. Reconeixen els antígens quan estan units a l'MHC de classe II. La seva funció és la d'ajudar tant als limfòcits T com als B i als fagòcits per tal que funcionin correctament.
Aquests limfòcits es poden dividir atenent la funció que realitzen i el patró de citocines que sintetitzen, en Th1 o Th2.[1] La decisió final que pren per tal dirigir-se cap a alguna d'aquestes funcions es produeix durant el primer trobament de la cèl·lula T amb el patogen.
Hi ha un tercer tipus de limfòcit que utilitza un TCR diferent als que utilitzen els Th i Tc (limfòcits Tαβ), s'anomena limfòcit Tγδ. La seva funció és la de lisi de cèl·lules infectades per virus o micobacteris.[2]
Estructura del receptor dels limfòcits T

Els limfòcits T tenen receptors a la seva superfície que permeten el reconeixement de l'antigen que, en unir-se al receptor, provoca l'activació de la cèl·lula. Aquests receptors (TCR) són heterodímers amb una cadena α i una altra de β (no tan freqüentment cadenes γ i δ– població minoritària) que tenen dominis estructurals d'un funcionament semblant. Aquestes es basen en la unió, mitjançant una regió transmembrana helicoidal amb dominis curts i cua citosòlica, d'una part estructural variable (lloc d'unió amb l'antigen) i un domini immunoglobulina (Ig) constant. A més a més, la cadena α del TCR té en concret 260 aminoàcids i la β, al voltant de 300. Ambdues cadenes formen ponts disulfur intracatenaris que defineixen dominis globulars i també presenten cadenes laterals de sucres unides entre elles. Entre les cadenes, hi ha un segment que representa el fragment transmembrana de l'heterodímer, on α i β estan unides covalentment per cisteïnes.[3][4]

Degut a la presència de cadenes variables en aquests TCR, existeix una gran variabilitat. Comunament, els TCR reconeixen pèptids curts d'uns 8-30 aminoàcids de longitud. A més a més, aquests pèptids han de mantenir-se units a una molècula del sistema principal d'histocompatibilitat (MHC) per tal que el TCR pugui reconèixer-la. Per aquest motiu, es diu, que les molècules d'histocompatibilitat presenten els pèptids als limfòcits T.
Els mecanismes pels quals es genera la diversitat del TCR són la gran flexibilitat d'imprecisió en les unions dels segments de DNA, l'alineació per escissió intrònica i la unió de les dues cadenes variables. Aquests receptors, de la mateixa manera que ho fan els anticossos, es formen per recombinació somàtica d'un nombre limitat de segments genètics, a partir dels quals poden originar-ne milions de receptors diferents segons la combinació de cadenes α i β, amb una indeterminació a la unió que augmenta encara més aquesta diversitat.
La transducció del senyal a l'interior de la cèl·lula es duu a terme per una molècula associada a la unitat de reconeixement del receptor antigènic, el complex CD3, que també regula l'assemblatge, el transport i l'estabilització del receptor a la membrana. Aquest complex està format per cadenes CD3γ, CD3δ i CD3ε, associades a una cadena ζ, unió que es produeix al reticle endoplasmàtic. Les cadenes CD3 γ i CD3δ estan glucosilades mentre que les CD3ε i ζ, són proteïnes integrals de membrana unides no covalentment entre si (les ζ formen ponts disulfur).
Maduració i selecció dels limfòcits T
Maduració
Els precursors de limfòcits T són cèl·lules hematopoètiques que migren a través del torrent sanguini des de la medul·la òssia fins al tim on té lloc la maduració. Els limfòcits T que s'estan desenvolupant en aquest òrgan limfoide són coneguts com a timòcits.[5][6]
En la maduració té lloc l'expressió de receptors d'antigen (TCR). En els timòcits que acaben d'arribar al tim encara no s'ha dut a terme la recombinació somàtica, i aquests no presenten els marcadors CD3, complex TCR, i coreceptors CD4 i CD8 que són propis d'una cèl·lula madura. La manca d'aquests coreceptors fa que es denominin dobles negatius. Aquest estadi de maduració és el dels limfòcits pro-T que proliferen gràcies a l'actuació de la interleucina IL-7 i és l'estadi on es diferencien els limfòcits Tαβ dels Tγδ.
La majoria de les cèl·lules estan destinades a ser Tαβ, expressant així la cadena β del receptor. Aquesta cadena β, unida a la proteïna pre-Tα, s'associa amb el CD3 per formar els receptors dels limfòcits pre-T. El següent estadi maduratiu és el corresponent al dels dobles positius, ja que s'expressen el CD4 i el CD8, i s'inicia el procés de selecció positiva i negativa. Durant aquest procés només acaben de madurar un 2% del timòcits.
Selecció
La selecció dels limfòcits T és un procés mitjançant el qual se seleccionen aquells limfòcits T immadurs que tenen receptors d'antígens útils. Podem diferenciar dues parts: la selecció positiva i la negativa. Com ja sabem, els limfòcits T només reconeixen un antigen quan està unit al complex d'histocompatibilitat principal (MHC).
Durant la selecció positiva, se seleccionen els limfòcits capaços de reconèixer i interaccionar amb el MHC propi, aquells que estableixen una unió de baixa afinitat amb el MHC. Aquells que no reconeixen el MHC propi se’ls indueix a l'apoptosi. En la selecció positiva, també es diferencien els limfòcits que identifiquen el MHC de classe I (els CD8+) i aquells que reconeixen el de classe II (els CD4+), anomenats llavors timòcits simples positius.
En canvi, en la selecció negativa s'eliminen els limfòcits que identifiquen antígens propis com estranys, s'uneixen fortament a ells i provoquen una resposta immunitària.
En resum, se seleccionen aquells limfòcits capaços de reconèixer el MHC propi i que són tolerants amb els antígens de l'organisme.
Actuació
Reconeixement de l'antigen i cèl·lules presentadores

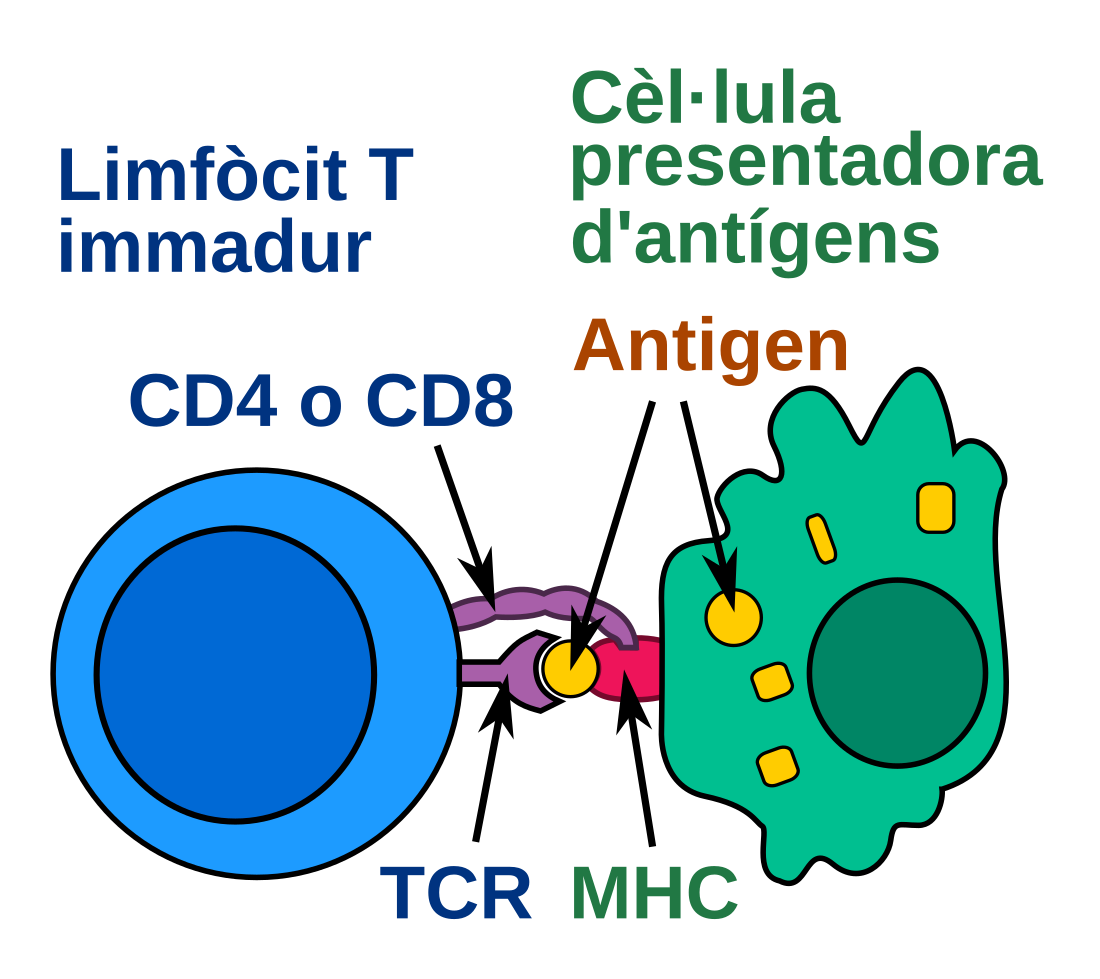
El mecanisme d'actuació de cada limfòcit T és diferent. Tot i així, a diferència dels limfòcits B que reconeixen l'antigen directament, tots s'activen mitjançant la presentació d'antígens. L'agent patogen és capturat per les cèl·lules presentadores d'antígens (CPA), majoritàriament macròfags, que degraden l'antigen. D'aquesta manera, els pèptids simples (de 10 aminoàcids aproximadament) de les proteïnes de la superfície de l'agent s'uneixen específicament al complex major d'histocompatibilitat (MHC) del macròfag. En aquest cas, el receptor dels limfòcits T (TCR) és específic pel complex pèptid-MHC, que constitueix un epítop o determinant antigènic lineal. I, per tant, el MHC i els pèptids s'exposen a la membrana del macròfag activat que circula pel torrent sanguini per tal de trobar limfòcits. Conseqüentment, el seu receptor reconeix els pèptids derivats de proteïnes antigèniques, presents a la superfície de les CPA, i el limfòcit T s'activa.
Activació i senyal coestimulador
Els limfòcits T verges són cèl·lules que es troben a la fase G0 del cicle cel·lular i s'han d'activar per començar la seva proliferació i diferenciació.
L'activació s'inicia amb la interacció entre TCR i el pèptid antigènic. La baixa afinitat d'aquesta interacció es veu potenciada per la presència de coreceptors, com el CD4, i altres molècules de membrana, que la reforcen i tradueixen el senyal activador a l'interior de la cèl·lula.
Aquesta interacció activa una complexa cascada de reaccions bioquímiques, en què són essencials les cinases i les fosfatases. Aquestes culminen amb l'activació i expressió de diversos gens, com el IL-2 (interleucina-2) i el del seu receptor, per a la proliferació clonal i diferenciació dels limfòcits T en subpoblacions. La secreció autocrina de IL-2 fa que els limfòcits T surtin de la fase G0, entrin i progressin en el cicle cel·lular. Tot i així, també són necessàries una sèrie de senyals coestimuladors. L'absència de cooperació entre la interacció TCR-pèptid-MHC i els senyals coestimuladors porten a un estat d'incapacitat de resposta immunitària, anergia.
Aquests senyals addicionals consisteixen en:
- Citocina IL-1, subministrada per la CPA.
- Citocina IL-6, de la CPA
- Senyal resultant del contacte entre molècula B7 de la CPA i la CD28 del limfòcit T. És el senyal més potent. La molècula B7 consta de dues cadenes idèntiques amb 2 dominis de tipus immunoglobulina. S'expressa només en CPA que estimulen limfòcits T. Té dues formes estructurals, B7.1 i B7.2. Per altra banda, la CD28 és una glicoproteïna homodimèrica present en els limfòcits T en repòs. Cada cadena presenta un domini de tipus V-Ig i està glucosilada.
Aquest darrer senyal, CD28-B7, provoca un efecte sinèrgic sobre el senyal transmès des del complex TCR-CD3, que augmenta la producció de IL-2 i la proliferació de limfòcits.
Referències
Enllaços externs
Wikiwand - on
Seamless Wikipedia browsing. On steroids.