Michaelis–Mentenova kinetika
From Wikipedia, the free encyclopedia
Michaelis–Mentenova kinetika – u biohemiji – jedan je od najpoznatijih modela enzimske kinetike. Imenovana je po njemačkom biohemičaru Leonoru Michaelisu i kanadskoj ljekarnici Mudu Mentenu. Ovaj model ima oblik jednadžbe koja opisuje stopu enzimskih reakcija, povezujući reakcijsku stopu sa , koncentracijom enzimskog supstrata S. Njegovu formulu sadrži izraz:
- ,

gdje = maksimalna postignuta brzina sistema, pri maksimalnoj (zasićenju) koncentraciji supstrata. Michaelisova konstanta je koncentracija podloge na kojoj je stopa reakcija polovina [1] Za biohemijsku reakcija koja uključuje jedan supstrat obično se pretpostavlja da prati Michaelis-Mentenovu kinetiku, bez obzira na pretpostavke modela.[2][3][4]
Model

S – supstrat
ES – Kompleks enzim-supstrat
P – Produkt
Godine 1903, francuski fizički hemičar Victor Henri našao je da su enzimske reakcije su pokrenute vezama (općenitije, interakcijom vezivanja) između enzima i supstrata. Njegov rad su preuzeli njemačka biohemičar Leonor Michaelis i kanadski ljekar Maud Menten, koji su istraživali kinetiku mehanizam enzimskih reakcija invertaze, koja katalizira hidrolizu saharoze u glukozu i fruktozu. U 1913, predložili su matematički model reakcije. Ona uključuje enzim E vezivanje za supstratenzim supstrat S formirajući kompleks ES, što se pretvara u proizvod P i enzim. To može biti predstavljeno kao:
gdje , i označavaju konstantu stopa, a dvostruke strelice između S i ES predstavljaju pojavu da je veza enzim-supstrat reverzibilni proces.
Pod određenim pretpostavkama, kao što su da je koncentracija enzima mnogo manja nego što je koncentracija supstrata – stopa formiranja proizvoda je:
Reakcijska stopa raste sa povećanjem koncentracije supstrata , asimptotski se približava svojom maksimalnom brzinom , postignuta je kada je sav enzim vezan za podlogu. Također slijedi da , where i je početne koncentracije enzima. , broj prometa, je maksimalan broj molekula supstrata pretvorenih u proizvod po molekuli enzima u sekundi.[5]
Michaelisova konstanta je koncentracija podloga na kojoj je stopa reakcija je na pola maksimuma i je inverzna mjera afiniteta podloge za enzim; mala ukazuje na visok afinitet, što znači da će stopa biti brža. Vrijednost ovisi i o enzimu i supstratu, kao i uvjetima reakcije, kao što su temperatura i pH.[6][7][8][9][10][11]
Definiranje konstanti
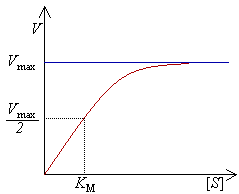
Za određivanje maksimalne brzine enzimski kataliziranih reakcija, koncentracija supstrata se povećava sve dok se ne ostvari konstantna brzina stvaranje proizvoda. Ta brzina predstavlja maksimalnu brzinu (Vmax) enzima. U ovom stanju, [[aktivno mjesto|aktivna mjesta enzima su zasićena supstratom. Faktori koji utiču na brzinu enzimskih reakcija (kao što su pH, temperature i dr.) su također podešeni na optimalne vrijednosti.
Reakcijska brzina /'V'
Brzina reakcije predstavlja broj njenih ponavljanja, koja su enzimski katalizirana, u jednoj sekundi. Sa povećanjem koncentracije supstrata [S], brzina reakcije (koja odgovara konstantnoj koncentraciji enzima) se asimptotski približava maksimalnoj brzini Vmax, ali je zapravo nikada ne dostigne. Zbog toga, ne postoji [S] koji odgovara Vmax. Umjesto toga, karakteristična vrijednost za dati enzim je definirana koncentracijom supstrata koja odgovara polovini maksimalne brzine (Vmax/2). Ova KM vrijednost se označava kao Mihaelis-Menten konstanta.
Mihaelisova konstanta 'KM
Budući da se koncentracija supstrata koja odgovara max ne može sasvim tačno eksperimentalno odrediti, enzimi se karakteriziraju koncentracijom supstrata koja odgovara polovini maksimalne brzine. Ta koncentracija se naziva Mihaelis-Mentenova konstanta (KM) ili Mihaelis konstanta. Za sve enzime koji se ponašaju po jednostavnoj Mihaelis-Mentenovoj kinetici, ona predstavlja konstantu disocijacije (afinitet supstrata) u kompleksu enzim-supstrat (ES). Niska vrijednost Km pokazuje da je (ES) kompleks dosta stabilan i da rijetko disocira bez formiranja produkta.
KM se može upotrebljavati za opisivanje afiniteta enzima prema supstratu, onda kada je k2 brzinski ograničavajuća, tj. k2 << k1 i KM postaje k-1/k1. Često, k2 >> k1, ili k2 i k1 su istog reda veličine.
Aplikacije
Vrijednosti parametra široko variraju između različitih enzima:
| Enzim | (M) | (1/s) | (1/M*s) |
|---|---|---|---|
| Himotripsin | 1.5 × 10−2 | 0.14 | 9.3 |
| Pepsin | 3.0 × 10−4 | 0.50 | 1.7 × 103 |
| Tirozil-tRNK sintetaza | 9.0 × 10−4 | 7.6 | 8.4 × 103 |
| Ribonukleaza | 7.9 × 10−3 | 7.9 × 102 | 1.0 × 105 |
| Ugljik anhidraza | 2.6 × 10−2 | 4.0 × 105 | 1.5 × 107 |
| Fumaraza | 5.0 × 10−6 | 8.0 × 102 | 1.6 × 108 |
Konstanta (katalitska efikasnost) je mjera koliko enzim efikasno pretvara supstrat u proizvod. Difuzijom ograničeni enzimi, kao što je fumaraza, rade na teorijski gornjoj granici: 10 8 – 10 10/M*e, ograničene difuzije supstrata u aktivnom mjestu.
Michaelis–Mentenova kinetika se može primijeniti na različite sfere izvan biohemijskih reakcija, uključujući čišćenje prašine u plućinm alveolama u mnoštvu vrsta, sa niskim alkoholom u krvi, u Pi odnosima fotosintetskog zračenja i infekcijama bakterijskim fagima.
Izvođenje
Primjena zakona masovne akcije, prema kojem j je stopa reakcija proporcionalna proizvodu koncentracija reaktanata (tj [E] [S]), daje sistem od četiri nelinearne obične diferencijalne jednadžbe, koje definiraju stopu promjene reaktanata s vremenom
:
U ovom mehanizmu, enzim E je katalizator, što samo olakšava reakcije, tako da je njegova ukupna koncentracija, slobodna plus kombinirana konstanta. Ovaj zakon očuvanja može se uočiti dodavanjem prve i treće gornje jedndžbe.
Aproksimacija ravnoteže
U izvornoj analizi, Michaelis i Menten pretpostavljaju da je podloga u trenutnoj hemijskoj ravnoteži sa kompleksom, što podrazumijeva:
Iz zakona o enzimskoj konzervaciji, dobija se:
Kombiniranjem dva gornja izraza, dobije se:
Pojednostavljeno, dobijamo:
gdje je disocijacijska konstanta za kompleks enzim-supstrat. Zato je brzina reakcije of the reaction –stopa po kojoj se formira P:
gdje je maksimalna brzina reakcije.
Aproksimacije lažno-stabilnog stanja
Alternativnu analizu sistema su preduzeli britanski botaničar G. E. Briggs i britanski genetičar J. B. S. Haldane u 1925. Oni su pretpostavili da se koncentracija prijelaznog kompleksa na vremenskoj skali ne mijenja od formiranja proizvoda, što je poznato kao pretpostavka o kvazi-stabilnom stanju ili pseudo-ustaljenom stanjau. Matematički, ova pretpostavka znači .
Kombinirajući taj odnos sa zakonom očuvanja enzima, koncentracija kompleksa je:
gdje je
Poznatp kao Michaelisova konstanta, u kojoj su , i konstante nevezanog supstrata, konverzije u produkt i vezanje za enzim. Zato je brzina reakcije :
Pretpostavke i ograničenja =
Prvi korak u izvođenju primjenjuje zakon masovne akcije, koja se oslanja na slobodnu difuziju. Međutim, u okruženju žive ćelije, u kojoj postoji visoka koncentracija proteina, citoplazma se često ponaša više kao gel nego sol (tečnost), ograničavajući kretanje molekula i mijenjanjajući stope reakcija. Iako zakon masovne akcije može biti važeći u heterogenim okruženjima, prikladniji je za modeliranje citoplazme kao fraktala, kako bi snimili kinetiku ograničene-mobilnosti. Rezultirajuće stope reakcija predviđaju dva pomenuta pristupa su slična, s jedinom razlikom što se aproksimacija ravnoteže definira kao konstanta, dok je kvazi-stabilnom stanju aproksimacije upotrebljava . Međutim, svaki pristup se temelji na drugačijoj pretpostavci. Analiza Michaelis-Mentenove ravnoteže je važeća ako supstrat postigne ravnotežu srazmjerno mnogo brže nego što je formiran proizvod ili, preciznije, da:
Nasuprot tome, Briggs–Haldanova analiza kvazi stabilnog stanja vrijedi ako:
Stoga je održiva onda kada ako je koncentracija enzima mnogo manja nego koncentracija supstrata. Čak i ako i ovo ne zadovoljava, aproksimacija je važeća ako je velika.
U obje, Michaelis-Menten i Briggs-Haldane analize, kvalitet aproksimacije dokazuje smanjenje as . Međutim, Michaelis-Mentenov model kinetike se često podržava, bez obzira na pretpostavke.
Također je važno imati na umu da, iako je ireverzibilna, neophodno je pojednostavljenje, kako bi se našlo prihvatljivo analitičko rješenje. Reakcija enzima je ispravnije opisana kao
Uopćeno, pretpostavka o nepovratnosti je dobra u situacijama u kojima je istinit jedan od uvjeta ispod:
- 1. Koncentracija supstrata (e) je mnogo veća nego što je koncentracija proizvoda;
Ovo je istinito u uvjetima standardnih istraživanja in vitro i za većinu in vivo bioloških reakcije, osobito gdje se produkt neprekidno otklanja putem postepenih reakcija.
- 2. Oslobođena energija reakcije je vrlo velika, kada je:
U situacijama kada nema niti jednog od ova dva prethodna uvjeta (reakcijska energij je niska i postoje značajne količine gotovih proizvoda), Michaelis-Mentenova jednadžba ne odgovara, ia pristup složenijem modeliranju izričito uzima u obzir prethodne i naredne reakcije, da bi se shvatila biologija datog enzima.
Historija
Međusobni odnos između koncentracija supstrata i enzima prvi su ustanovili 1913. godine Leonor Mihaelis i Maud Menten, prateći ranije radove Archibalda Viviana Hila.[12]
Matematičku formulaciju su izveli G. E. Briggs i J. B. S. Haldane.[13]
Također pogledajte
Reference
Vanjski linkovi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.


![{\displaystyle [S]}](http://wikimedia.org/api/rest_v1/media/math/render/svg/292bbb82029aa583c5d2ac5fa1d7e4fedf537d8b)
![{\displaystyle v={\frac {d[P]}{dt}}={\frac {V_{\max }{[S]}}{K_{\mathrm {M} }+[S]}}.}](http://wikimedia.org/api/rest_v1/media/math/render/svg/84e7687f5e75c518c46953ef57e4bf3358e36900)







![{\displaystyle v={\frac {d[P]}{dt}}=V_{\max }{\frac {[S]}{K_{\mathrm {M} }+[S]}}=k_{\mathrm {cat} }[E]_{0}{\frac {[S]}{K_{\mathrm {M} }+[S]}}.}](http://wikimedia.org/api/rest_v1/media/math/render/svg/573e95804d450760bd4cc300b168b8ec9ad4e63f)
![{\displaystyle V_{\max }=k_{\mathrm {cat} }[E]_{0}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/ec8ad5bbfbdd33c4154648155442145135224ca2)
![{\displaystyle [E]_{0}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/409eb69aba4c3afa67a48af6d9f976a28445c544)

 ...
...

![{\displaystyle {\begin{aligned}{\frac {d[E]}{dt}}&=-k_{f}[E][S]+k_{r}[ES]+k_{cat}[ES]\\{\frac {d[S]}{dt}}&=-k_{f}[E][S]+k_{r}[ES]\\{\frac {d[ES]}{dt}}&=k_{f}[E][S]-k_{r}[ES]-k_{cat}[ES]\\{\frac {d[P]}{dt}}&=k_{cat}[ES].\end{aligned}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/98633272b269a151ae0fe89b4f1f56a6c6d7e4c7)
![{\displaystyle [E]+[ES]=[E]_{0}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/ad13d24a63d5ee09ed542b5a281471be77a68b09)
![{\displaystyle k_{f}[E][S]=k_{r}[ES].}](http://wikimedia.org/api/rest_v1/media/math/render/svg/a09733b885fcbab94fc26972ead892e7140e98a3)
![{\displaystyle [E]=[E]_{0}-[ES].}](http://wikimedia.org/api/rest_v1/media/math/render/svg/3f666594c389c604937e55eba6c9262c9752c325)
![{\displaystyle k_{f}([E]_{0}-[ES])[S]=k_{r}[ES].}](http://wikimedia.org/api/rest_v1/media/math/render/svg/015e04ae8c8b60a6aaf2ad2c522682b3a5887cbc)
![{\displaystyle [ES]={\frac {[E]_{0}[S]}{K_{d}+[S]}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/30a04f01dbb158cb6083b5251a4e8320d4d86007)

![{\displaystyle v={\frac {d[P]}{dt}}={\frac {V_{\max }{[S]}}{K_{d}+[S]}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/61d1e492354949b99978e2b4ce255a54d3ca9359)
![{\displaystyle k_{f}[E][S]=k_{r}[ES]+k_{\mathrm {cat} }[ES]}](http://wikimedia.org/api/rest_v1/media/math/render/svg/0f1bd3bcae8e6f6a1e9e1491d0c2a0663bbb6650)
![{\displaystyle [ES]={\frac {[E]_{0}[S]}{K_{\mathrm {M} }+[S]}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/00b11a6e339b8e44363a480f8d43d24ffb81274d)




![{\displaystyle \epsilon _{m}={\frac {[E]_{0}}{[S]_{0}+K_{\mathrm {M} }}}\ll 1.}](http://wikimedia.org/api/rest_v1/media/math/render/svg/aa89cac53969f3716dd4e1aeee0cbbbe0674de1e)


![{\displaystyle [S]\gg [P].}](http://wikimedia.org/api/rest_v1/media/math/render/svg/ab1ee2b94acfa36c19c30fc7390d39aa2ddd3ae1)
