শীর্ষ প্রশ্ন
সময়রেখা
চ্যাট
প্রসঙ্গ
অ্যামিনো অ্যাসিড
গুরুত্বপূর্ণ জৈবপদার্থ উইকিপিডিয়া থেকে, বিনামূল্যে একটি বিশ্বকোষ
Remove ads
অ্যামিনো অ্যাসিড হল জৈব যৌগ যাতে অ্যামিনো এবং কার্বক্সিলেট ফাংশনাল গ্রুপ বিদ্যমান থাকে, সাথে প্রতিটি অ্যামিনো অ্যাসিডের জন্য নির্দিষ্ট একটি সাইড চেইনও (R গ্রুপ) থাকে।[১] প্রতিটি অ্যামিনো অ্যাসিডে উপস্থিত মৌলগুলি হলো কার্বন (C), হাইড্রোজেন (H), অক্সিজেন (O), এবং নাইট্রোজেন (N); এছাড়াও সিস্টাইন এবং মেথিওনিনের পার্শ্ব শৃঙ্খলে সালফার (S) থাকে এবং কম প্রচলিত অ্যামিনো অ্যাসিড, যেমন সেলেনোসিস্টাইনে সেলেনিয়াম (Se) উপস্থিত থাকে। ২০২০-এর হিসাব অনুযায়ী[হালনাগাদ], ৫০০ টিরও বেশি প্রাকৃতিকভাবে প্রাপ্ত অ্যামিনো অ্যাসিড, পেপটাইড যৌগসমূহের মনোমার একক গঠন করে বলে জানা যায়, যেসব পেপটাইড যৌগসমূহের মধ্যে প্রোটিনও অন্তর্ভুক্ত। [২] (যদিও জেনেটিক কোডে মাত্র 20টি দেখা যায়, অতিরিক্ত দেখা যায় সেলেনোসিস্টাইন, যা একটি বিশেষ উপায়ে এনকোড করা হয়)। [৩]

জৈব-রাসায়নিক নামকরণের যৌথ কমিশন[৪] (Joint Commission on Biochemical Nomenclature) অ্যামিনো অ্যাসিডসমূহের আনুষ্ঠানিক নাম প্রদান করেঃ এক্ষেত্রে তারা চিত্রে দেখানো অ্যামিনো অ্যাসিডের (এল-অ্যামিনো অ্যাসিড) কাল্পনিক "নিরপেক্ষ" কাঠামোর পরিপ্রেক্ষিতে নামকরণ করে থাকে।
উদাহরণস্বরূপ, অ্যালানিনের পদ্ধতিগত নাম হল 2-অ্যামিনোপ্রোপ্যানোইক অ্যাসিড যা নির্ভর করে এর গাঠনিক সংকেত, CH3-CH(NH2)-COOH এর উপর। উক্ত কমিশন এই পদ্ধতির যথার্থতা নিম্নরূপে তুলে ধরে :
প্রদত্ত পদ্ধতিগত নাম এবং সংকেতগুলো অনুমানমূলক (রাসায়নিক) গঠন নির্দেশ করে যেখানে অ্যামিনো গ্রুপগুলি হাইড্রোজেনমুক্ত (unprotonated) এবং কার্বক্সিল গ্রুপগুলি অবিভাজিত (undissociated)। এই রীতিটি বিভিন্ন নামকরণ সংক্রান্ত সমস্যা এড়ানোর ক্ষেত্রে কার্যকর কিন্তু, এর দ্বারা এমনটা বোঝানো ঠিক হবে না যে এই (গাঠনিক) কাঠামোগুলি অ্যামিনো-অ্যাসিড অণুগুলোর একটি মাত্রা পরিমাণ অংশের প্রতিনিধিত্ব করে।
প্রকারভেদ ও অবস্থান
অ্যামিনো অ্যাসিডগুলোকে মূল কাঠামোগত কার্যকরী মূলকগুলির অবস্থান অনুসারে আলফা- (α-), বিটা- (β-), গামা- (γ-) বা ডেল্টা- (δ-) শ্রেণিতে বিন্যস্ত করা যেতে পারে; অন্যান্য শ্রেণীগুলি রাসায়নিক মেরুতা বা পোলারিটি, আয়নিকরণ, এবং পার্শ্ব-শিকল গ্রুপ টাইপ ( এলিফ্যাটিক, অ্যাসাইক্লিক, অ্যারোমেটিক, হাইড্রক্সিল বা সালফার ধারণকারী, ইত্যাদির সাথে সম্পর্কিত)। অ্যামিনো অ্যাসিডের অবশিষ্টাংশগুলি , প্রোটিনরুপে মানুষের পেশী এবং অন্যান্য টিস্যুগুলির দ্বিতীয় বৃহত্তম গাঠনিক উপাদান (পানি হল বৃহত্তম) হিসেবে বিরাজ করে। [৫] এছাড়া, প্রোটিনের অবশিষ্টাংশ (protein residues) হিসাবে তাদের ভূমিকা ছাড়াও, অ্যামিনো অ্যাসিডগুলি নিউরোট্রান্সমিটার পরিবহন এবং জৈব সংশ্লেষণের মতো অনেকগুলি প্রক্রিয়াতে অংশগ্রহণ করে।
Remove ads
ইতিহাস
সারাংশ
প্রসঙ্গ
প্রথম কয়েকটি অ্যামিনো অ্যাসিড ১৯০০-এর দশকের গোড়ার দিকে আবিষ্কৃত হয়েছিল।[৬][৭] ১৮০৬ সালে ফরাসি রসায়নবিদ লুই-নিকোলাস ভাউকুলিন এবং পিয়েরে জিন রবিকেট অ্যাসপারাগাস থেকে একটি যৌগ নিষ্কাশন করেছিলেন যা পরবর্তীকালে অ্যাসপারাগিন নামে পরিচিতি পেয়েছিল- এটিই ছিল প্রথম আবিষ্কৃত অ্যামিনো অ্যাসিড।[৮][৯] সিস্টিন আবিষ্কৃত হয়েছিল ১৮১০ সালে,[১০] যদিও এর মনোমার- সিস্টেইন ১৮৮৪ সাল পর্যন্ত অনাবিষ্কৃত ছিল।[১১][ক]
১৮২০ সালে গ্লাইসিন এবং লিউসিন আবিষ্কৃত হয়।[১২] আবিষ্কৃত ২০ টি সাধারণ অ্যামিনো অ্যাসিডের মধ্যে শেষটি ছিল থ্রেওনিন যেটি উইলিয়াম কামিং রোজ ১৯৩৫ সালে আবিষ্কার করেছিলেন, (এছাড়াও) তিনি অপরিহার্য অ্যামিনো অ্যাসিডও নিরুপণ করেছিলেন এবং অত্যানুকুল বৃদ্ধির (optimal growth) জন্য সকল অ্যামিনো অ্যাসিডের ন্যূনতম দৈনিক চাহিদা নির্ধারণ করেছিলেন।[১৩][১৪]
(অ্যামিনো অ্যাসিড) রাসায়নিক যৌগশ্রেণীর একত্ব (unity) ১৮৬৫ সালে বিজ্ঞানী উর্টজ কর্তৃক প্রথম চিহ্নিত হয়েছিল, তবে তিনি এর কোনও নির্দিষ্ট নাম দেননি।[১৫] ইংরেজি ভাষায় "অ্যামিনো অ্যাসিড" শব্দটির প্রথম ব্যবহার ১৮৯৮ সাল থেকে শুরু হয়,[১৬] আর; জার্মান শব্দ, Aminosäure, এর আগে থেকে ব্যবহৃত হচ্ছিল।[১৭] দেখা যায় যে, এনজাইমঘটিত বিপাকক্রিয়া বা অম্ল পানি-বিশ্লেষণ (অ্যাসিড হাইড্রোলাইসিস-acid hydrolysis) পরবর্তী ধাপে প্রোটিনগুলি অ্যামিনো অ্যাসিড উৎপন্ন করে থাকে। ১৯০২ সালে, এমিল ফিশার এবং ফ্রাঞ্জ হফমেস্টার স্বাধীনভাবে প্রস্তাব করেছিলেন যে, প্রোটিনগুলি অনেক অ্যামিনো অ্যাসিড থেকে গঠিত হয়, যার ফলে একটি অ্যামিনো অ্যাসিডের অ্যামিনো গ্রুপের সাথে অন্য অ্যামিনো অ্যাসিডের কার্বোক্সিল গ্রুপের বন্ধন তৈরি হয় , যার ফলে একটি রৈখিক কাঠামো তৈরি হয় যেটিকে বিজ্ঞানী ফিশার "পেপটাইড" (পেপটাইড বন্ধন) বলে অভিহিত করেছিলেন।[১৮]
Remove ads
সাধারণ গঠন
সারাংশ
প্রসঙ্গ
এই পাতার শীর্ষে দেখানো কাঠামোতে R বলতে প্রতিটি অ্যামিনো অ্যাসিডের জন্য নির্দিষ্ট একটি পার্শ্ব চেইন বুঝায়। কার্বক্সিল গ্রুপের পাশে থাকা কার্বন পরমাণুকে α–কার্বন বলা হয়। α-কার্বনের সাথে সরাসরি সংযুক্ত একটি অ্যামিনো গ্রুপ ধারণকারী অ্যামিনো অ্যাসিডগুলিকে α-অ্যামিনো অ্যাসিড হিসাবে উল্লেখ করা হয়। [১৯] এর মধ্যে রয়েছে প্রোলিন এবং হাইড্রোক্সিপ্রোলিন , যেগুলো সেকেন্ডারি অ্যামাইন এর অন্তর্ভুক্ত । পূর্বে এগুলিকে প্রায়শই ইমিনো অ্যাসিড বলা হত, যেটি ছিল একটি ভুল নাম, কারণ এগুলোতে কোন ইমাইন গ্রুপিং (HN=C) থাকে না । [২০] তথাপিও, পুরাতন নামটি প্রায়শই ব্যবহৃত হয়।
সমরুপতা (Isomerism)
অ্যামিনো অ্যাসিডের সাধারণ প্রাকৃতিক রুপগুলির গঠনে রয়েছে -NH3+ (প্রোলিনের ক্ষেত্রে -NH2+-) এবং -CO2- কার্যকরী মূলক একই C পরমাণুর সাথে সংযুক্ত থাকে, এবং এইকারণে এরা α-অ্যামিনো অ্যাসিড শ্রেণীভুক্ত। অ্যাকাইরাল গ্লাইসিন বাদে, সকল প্রাকৃতিক অ্যামিনো অ্যাসিডের এল কনফিগারেশন রয়েছে,[২১] এবং এগুলো শুধুমাত্র রাইবোসোমে রুপান্তরণের (translation) সময় প্রোটিনে পাওয়া যায়।
অ্যামিনো অ্যাসিড কনফিগারেশনের এল এবং ডি নিয়মটি অ্যামিনো অ্যাসিডের নিজস্ব আলোক ক্রিয়াকে (optical activity) বোঝায় না বরং গ্লিসারালডিহাইডের আইসোমারের আলোক ক্রিয়াকে বোঝায় যেখান থেকে তাত্ত্বিকভাবে অ্যামিনো অ্যাসিড সংশ্লেষিত হতে পারে ( ডি -গ্লিসারালডিহাইড ডান-ঘূর্ণীঃ dextrorotatory ; এল -গ্লিসারালডিহাইড বাম-ঘূর্ণীঃ levorotatory)।
একটি বিকল্প নিয়ম হল, পরম কনফিগারেশন নির্দিষ্ট করার জন্য ( S ) এবং ( R ) নির্দেশক ব্যবহার করা। [২২] প্রোটিনের প্রায় সমস্ত অ্যামিনো অ্যাসিডের α কার্বন ( S ) রুপে থাকে, যার মধ্যে সিস্টাইন ( R ) এবং গ্লাইসিন অ- কাইরাল। [২৩] অন্যান্য অ্যামিনো অ্যাসিডের মতো একই জ্যামিতিক অবস্থানে সিস্টাইনের পার্শ্ব-শিকল রয়েছে, কিন্তু R / S পরিভাষাটি বিপরীত; কারণ কার্বক্সিল অক্সিজেনের তুলনায় সালফারের পারমাণবিক সংখ্যা বেশি, তাই ক্যান-ইনগোল্ড-প্রিলোগ এর অনুক্রম নিয়ম মতে পার্শ্ব চেইন উচ্চতর অগ্রাধিকার পেয়ে থাকে, বিপরীতে কার্বক্সিল গ্রুপের তুলনায় বেশিরভাগ অন্যান্য পার্শ্ব -শিকলে পরমাণুগুলি তাদের কম অগ্রাধিকার দেয়। [২২]
ডি -অ্যামিনো অ্যাসিডের অবশিষ্টগুলো কিছু প্রোটিনে পাওয়া যায়, কিন্তু তারা বিরল।
পার্শ্ব-শিকল সমূহ
অ্যামিনো অ্যাসিডগুলিকে α- হিসাবে মনোনীত করা হয় যেক্ষেত্রে অ্যামিনো নাইট্রোজেন পরমাণুটি α-কার্বনের সাথে সংযুক্ত থাকে, আর, কার্বন পরমাণুটি কার্বক্সিলেট গ্রুপের পাশেই থাকে।
নীচের সব ক্ষেত্রে মান (যদি থাকে) প্রোটিনের মধ্যে অ্যামিনো অ্যাসিডের অবশিষ্টাংশ হিসাবে গ্রুপগুলির আয়নীকরণ মান বুঝায়। তারা মুক্ত অ্যামিনো অ্যাসিডের মান নির্দেশ করে না (যার সামান্য প্রাণ-রাসায়নিক গুরুত্ব আছে)।
আলিফ্যাটিক পার্শ্ব-শিকল সমূহ
কতগুলো পার্শ্ব-শিকলে শুধুমাত্র H এবং C থাকে এবং এরা আয়নিত হয় না। এগুলি নিম্নরূপ (বন্ধনীতে তিন- এবং এক-অক্ষরের চিহ্ন সহ):

- গ্লাইসিন (গ্লাই, জি): (Gly, G): H-
- অ্যালানাইন (আলা, এ): (Ala, A): CH3-
- ভ্যালাইন (ভাল, ভি): (Val, V): (CH3)2CH-
- লিউসিন (লিউ, এল): (Leu, L) (CH3)2CHCH2-
- আইসোলিউসিন (ইলে, আই):(Ile, I):CH3CH2CH(CH3)
- প্রোলিন (প্রো, পি): (Pro, P): -CH2CH2CH2- অ্যামিনের উপর চাক্রিক কাঠামোকৃত (cyclized onto the amine)
নিরপেক্ষ মেরুক পার্শ্ব-শিকলসমূহ (Polar neutral side-chains)
দুটি অ্যামিনো অ্যাসিড অ্যালকোহল যুক্ত পার্শ্ব-শিকল ধারণ করে। এগুলি স্বাভাবিক অবস্থায় আয়নিত হয় না, যদিও একটি অ্যামিনো অ্যাসিড যার নাম সেরিন, সেটি সেরিন প্রোটিস দ্বারা প্রভাবনের (catalysis) সময় প্রোটন-বর্জিত (deprotonated:ডিপ্রোটোনেটেড) হয়ে যায়: এটি একটি খুবই ব্যতিক্রমী উদাহরণ, এবং সাধারণভাবে তা সেরিন অবশিষ্টাংশের (serine residues) বৈশিষ্ট্য নয়।
- সেরিন (Ser, S, https://wikimedia.org/api/rest_v1/media/math/render/svg/b030798b388df75544df8fc8c18fd46eaaf59a9b নাই, যখন খুবই ব্যতিক্রমী না হয়): HOCH2-
- থ্রিওনিন (Thr, T, https://wikimedia.org/api/rest_v1/media/math/render/svg/b030798b388df75544df8fc8c18fd46eaaf59a9b নাই ): CH3CHOH-
থ্রিওনিনের দুটি কাইরাল কেন্দ্র রয়েছে, শুধুমাত্র অ-কাইরাল গ্লাইসিন বাদে সমস্ত অ্যামিনো অ্যাসিডের সাধারণ α-কার্বনে যে এল (2 S ) কাইরাল কেন্দ্র আছে তা নয়, বরং β-কার্বনেও (3 R ) রয়েছে । সম্পূর্ণ স্টেরিও-রাসায়নিক বৈশিষ্টরুপ (stereochemical specification) হল এল -থ্রিওনিন (2 S ,3 R )।
অ্যামাইড পার্শ্ব-শিকলসমূহ
দুটি অ্যামিনো অ্যাসিডের অ্যামাইড পার্শ্ব-শিকল রয়েছে, যা নিম্নরূপ:
- অ্যাস্পারাজিন (Asn, N): NH2COCH2-
- গ্লুটামিন (Gln, Q): NH2COCH2CH2-
এই পার্শ্ব-শিকলগুলি pH-এর স্বাভাবিক পরিসরে আয়নিত হয় না।
সালফারযুক্ত পার্শ্ব-শিকলসমূহ
দুটি পার্শ্ব-শিকলে সালফার পরমাণু থাকে, যাদের মধ্যে একটি সাধারণ pH পরিসরে আয়নিত হয় ( নির্দেশিত) এবং অন্যটি হয় না:
- সিস্টাইন (Cys, C, ): SHCH2-
- মেথিওনিন (Met, M, নাই): CH3SCH2CH2-
অ্যারোমেটিক পার্শ্ব-শিকলসমূহ

চিত্রে পার্শ্ব-চেইন হিসাবে অ্যারোমেটিক বলয় যুক্ত তিনটি অ্যামিনো অ্যাসিডের গঠন দেখানো হয়েছে। এর মধ্যে, টাইরোসিন স্বাভাবিক পরিসরে আয়নিত করে; অন্য দুটি করে না)।
- ফিনাইল অ্যালানিন (Phe, F, নাই ): চিত্রে বামে
- টাইরোসিন(Tyr, Y, ) চিত্রে মাঝখানে
- ট্রিপটোফ্যান (Trp, W, নাই ): চিত্রে ডানে
ঋণাত্মক-ধর্মী (Anionic) পার্শ্ব-শিকলসমূহ
দুটি অ্যামিনো অ্যাসিডের সাইড-চেইন রয়েছে যা সাধারণ pH-এ অ্যাানায়ন। যদিও ভুল নামটি এতটাই বিস্তৃত যে তা শুধরানোর নয়, তবে এগুলিকে অ্যাসিডিক অ্যামিনো অ্যাসিড বলা উচিত নয়, কারণ তারা পেপসিনের মতো এনজাইমগুলি ব্যতীত সমস্ত ক্ষেত্রে ব্রনস্টেড বেস হিসাবে কাজ করে, অন্যদিকে পেপসিন স্তন্যপায়ী পাকস্থলীর মতো খুব কম pH-এর পরিবেশেও কাজ করে।
- অ্যাসপার্টেট ("অ্যাসপার্টিক অ্যাসিড নয় ", D, ): O2CCH2-
- গ্লুটামেট ( "গ্লুটামিক অ্যাসিড নয় ", Glu, E, ): -O2CCH2CH2-
ধণাত্মক-ধর্মী (Cationic) পার্শ্ব-শিকলসমূহ

সাইড-চেইন সহ তিনটি অ্যামিনো অ্যাসিড রয়েছে যা নিরপেক্ষ pH-এ ক্যাটায়ন (যদিও একটিতে যার নাম হিস্টিডিন, ক্যাটায়নিক এবং নিরপেক্ষ উভয় রুপই বিদ্যমান)। এগুলিকে সাধারণত ক্ষারীয় অ্যামিনো অ্যাসিড বলা হয়, কিন্তু এই শব্দটি বিভ্রান্তিকর: হিস্টিডিন, নিরপেক্ষ pH এ, ব্রনস্টেড অম্ল এবং ব্রনস্টেড ক্ষার উভয় হিসাবেই কাজ করতে পারে, লাইসিন ব্রনস্টেড অম্ল হিসাবে কাজ করে এবং আরজিনিনের একটি নির্দিষ্ট ধনাত্মক চার্জ থাকে এবং এটি নিরপেক্ষ অবস্থায় আয়নিত হয় না। । হিস্টিডিনিয়াম, লাইসিনিয়াম এবং আর্জিনিনিয়াম নামগুলি এদের গঠনগুলোর জন্য আরও সঠিক নাম হত, তবে মূলত এগুলোর প্রচলন নেই।
- হিস্টিডিন (His, H, ): সাম্যাবস্থায় প্রোটোনেটেড এবং ডিপ্রোটোনেটেড গঠনগুলি চিত্রের বাম দিকে দেখানো হয়েছে৷
- লাইসিন (Lys, K, ): চিত্রের মাঝখানে দেখানো হয়েছে
- আর্জিনাইন (Arg, R, ): চিত্রের ডানদিকে দেখানো হয়েছে
β- এবং γ-অ্যামিনো অ্যাসিড
NH3+-CXY-CO3- গঠনযুক্ত অ্যামিনো অ্যাসিড , যেমন β-অ্যালানাইন, কার্নোসিনের একটি উপাদান এবং অন্য আরো কয়েকটি পেপটাইডও হলো β-অ্যামিনো অ্যাসিড। NH3+-CXY-CXY-CO3- গঠনযুক্ত যৌগগুলো হলো γ-অ্যামিনো অ্যাসিড, এবং এভাবে চলবে, যেখানে X এবং Y হল দুটি প্রতিস্থাপক (যার মধ্যে একটি সাধারণত H হয়ে থাকে)।
জুইটার আয়ন সমূহ

অ্যামিনো অ্যাসিডসমূহ, জলীয় দ্রবণে মাঝারি pH-পরিসরে জুইটার আয়ন হিসাবে থাকে, অর্থাৎ চার্জিত অবস্থায় NH3+ এবং CO2- উভয় দ্বিপোলার আয়ন হিসাবে থাকে , তাই এর সামগ্রিক গঠন হলো NH3+-CHR-CO2- । শারীরবৃত্তীয় pH-এ (যেমন, মানব-শরীরে pH) তথাকথিত "নিরপেক্ষ রুপ" কোন পরিমাপযোগ্য পরিমাণে উপস্থিত থাকেনা। [২৪] যদিও বাস্তব কাঠামোতে চার্জ দুটির যোগফল শূন্য হয়, তবে মোট চার্জ শূন্যে হলেই কোন একটি একটি রাসায়নিক সত্তাকে মোটের উপর "অচার্জিত বা আধানহীন" বলা শুধু বিভ্রান্তিকরই নয়; ভুলও বটে।
খুব কম pH এ (3 এর নিচে), ক্যাবক্সিলেট গ্রুপ প্রোটোনেটেড হয়ে যায় এবং গঠনটি অ্যামোনিও কার্বক্সিলিক অ্যাসিডে পরিণত হয়, এটি পেপসিনের মতো এনজাইমের ক্ষেত্রে ঘটতে পারে যেগুলি অম্লীয় পরিবেশে সক্রিয় থাকে, যেমন স্তন্যপায়ীর পাকস্থলী এবং লাইসোসোম, কিন্তু অন্তঃ-কোষীয় এনজাইমের (intracellular enzymes) ক্ষেত্রে এটি উল্লেখযোগ্যভাবে ঘটে না। খুব বেশি pH এ (10-এর বেশি, যা সাধারণত শারীরবৃত্তীয় অবস্থাসমূহের ক্ষেত্রে দেখা যায় না), অ্যামোনিও গ্রুপটি ডিপ্রোটোনেটেড হয় এবং NH2-CHR-CO2- উৎপন্ন করে থাকে ।
যদিও রসায়নে অম্ল এবং ক্ষারের বিভিন্ন সংজ্ঞা ব্যবহার করা হয়, তবে জলীয় দ্রবণে রসায়নের জন্য উপযোগী একটিমাত্র সংজ্ঞা আছে তা দিয়েছিলেন বিজ্ঞানী ব্রনস্টেড :[২৫] অম্ল হল এমন একটি রাসায়নিক সত্তা যা অন্য সত্তাকে প্রোটন দান করতে পারে এবং ক্ষার হল সেই, যে একটি প্রোটন গ্রহণ করতে পারে। সংজ্ঞার এই মানদণ্ড অনুযায়ী, উপরের চিত্র ও ব্যাখ্যায় গ্রুপগুলিকে (অম্ল বা ক্ষার হিসেবে ) চিহ্নিত করা হয়েছে। খেয়াল রাখতে হবে যে, অ্যাসপার্টেট এবং গ্লুটামেট হল প্রধান গ্রুপ যেগুলি ব্রনস্টেড ক্ষার হিসাবে কাজ করে এবং এগুলিকে অম্লীয় অ্যামিনো অ্যাসিড হিসাবে সাধারণভাবে উল্লেখ করা (একসাথে সি টার্মিনালের সাথে) সম্পূর্ণ ভুল এবং বিভ্রান্তিকর। একইভাবে, তথাকথিত ক্ষারীয় অ্যামিনো অ্যাসিডগুলির মধ্যে এমন যৌগ (যেমন, হিস্টিডিন) আছে যা ব্রনস্টেড অম্ল এবং ক্ষার উভয় হিসাবে কাজ করে, আবার এমন আছে (যেমন,লাইসিন) যা প্রাথমিকভাবে একটি ব্রনস্টেড অম্ল হিসাবে কাজ করে এবং এমন আছে (যেমন,আরজিনাইন) যা সাধারণত অম্ল-ক্ষার আচরণের সাথে অপ্রাসঙ্গিক, যেহেতু এটির একটি নির্দিষ্ট ধনাত্মক চার্জ রয়েছে। উপরন্তু, টাইরোসিন এবং সিস্টাইন, যা প্রাথমিকভাবে নিরপেক্ষ pH এ অম্ল হিসাবে কাজ করে, এগুলো সাধারণত সাধারণ শ্রেণিবিভাগের সময় ভুলে অনুল্লেখিত থেকে যায়।
সমবৈদ্যুতিক বিন্দু (Isoelectric point)

অচার্জিত পার্শ্ব-শিকল সহ অ্যামিনো অ্যাসিডগুলির ক্ষেত্রে জুইটারায়নটি দুটি p K a মানের অন্তর্বর্তী pH মানগুলিতে প্রাধান্য বিস্তার করে, তবে অল্প পরিমাণ সার্বিক ঋনাত্মক এবং সার্বিক ধনাত্মক আয়নগুলির সাথে সাম্যাবস্থায় সহাবস্থান করে। দুটি p K a মানের মধ্যবর্তী মানে, অল্প পরিমাণ সার্বিক ঋনাত্মক এবং সার্বিক ধনাত্মক আয়নের পরিমাণ সমান হয়ে যায়, ফলে উপস্থিত সকল গঠনগুলোর গড় সার্বিক আধান শূন্য হয়। [২৬] এই pH মানটিই আইসোইলেক্ট্রিক বা সমবৈদ্যুতিক বিন্দু হিসাবে পরিচিত p I, তাই p I =+১/২ (p K a1 + p K a2 )।
যেসব অ্যামিনো অ্যাসিডে আধানযুক্ত পার্শ্ব-শিকল থাকে, তাদের ক্ষেত্রে পার্শ্ব-শিকলের
p K a এর মানও ধর্তব্য। সেহেতু, ঋনাত্মক পার্শ্ব-শিকল যুক্ত অ্যাসপার্টেট বা গ্লুটামেটের প্রান্তিক অ্যামিনো গ্রুপটি মূলত সম্পূর্ণরূপে চার্জযুক্ত আকারে NH3+ হিসেবে থাকে , কিন্তু এই ধনাত্মক চার্জটি এইভাবে সমতাকৃত হয় যে, একটি সি-টার্মিনাল কার্বক্সিলেট গ্রুপ বিপরীত ঋনাত্মক আধান যুক্ত হয়। এ অবস্থাটি দুটি কার্বক্সিলেট p K a মানের মাঝামাঝি মানে ঘটে: p I =+১/২ (p K a1 + p K a(R) ), যেখানে p K a(R) হল পার্শ্ব-শিকল p K a ।
অন্যান্য আয়নীকরণযোগ্য পার্শ্ব-শিকল যুক্ত অ্যামিনো অ্যাসিডের ক্ষেত্রেও অনুরূপ বিষয়াবলী বিবেচনাযোগ্য, যার মধ্যে শুধুমাত্র গ্লুটামেট-ই (অ্যাসপার্টেটের অনুরূপ), অন্তর্ভুক্ত নয়, বরং ধনাত্মক পার্শ্ব-শিকল যুক্ত সিস্টাইন, হিস্টিডিন, লাইসিন, টাইরোসিন এবং আরজিনাইনও অন্তর্ভুক্ত।
ইলেক্ট্রোফোরসিসের সময় অ্যামিনো অ্যাসিডঅসমূহ তাদের সমবৈদ্যুতিক বিন্দুতে কোন গতিশীলতা দেখায় না ( zero mobility), যদিও এই আচরণটি সাধারণত একক অ্যামিনো অ্যাসিডের চেয়ে পেপটাইড এবং প্রোটিনের জন্য বেশি ব্যবহৃত হয়। সমবৈদ্যুতিক বিন্দুতে জুইটারায়নসমূহ তাদের ন্যূনতম দ্রবণীয়তা দেখায়, এবং কিছু অ্যামিনো অ্যাসিডকে (বিশেষত, অপোলার পার্শ্ব-শিকল যুক্ত) পানি হতে অধঃক্ষেপণ দ্বারা নিষ্কাশন করা যায় যেক্ষেত্রে নির্দিষ্ট সমবৈদ্যুতিক বিন্দুতে pH এর মান সুসমঞ্জস্য করে নেয়া হয়।
Remove ads
অ্যামিনো অ্যাসিডের ভৌত-রাসায়নিক বৈশিষ্ট্যাবলী
সারাংশ
প্রসঙ্গ
সিএ. ২০ (ca. 20) কণিকাকৃতির অ্যামিনো অ্যাসিডগুলিকে তাদের বৈশিষ্ট্য অনুযায়ী শ্রেণীবদ্ধ করা যেতে পারে। শ্রেণিবিন্যাসের গুরুত্বপূর্ণ বিষয়গুলি হল আধান, পানি-আকর্ষণ বা পানি বিকর্ষণ ধর্ম (hydrophilicity or hydrophobicity), আকার এবং কার্যকরী গ্রুপ। [২১] এই বৈশিষ্ট্যগুলি প্রোটিন গঠন এবং প্রোটিন-প্রোটিনের মিথস্ক্রিয়াকে প্রভাবিত করে। জলে দ্রবণীয় প্রোটিনগুলির হাইড্রোফোবিক অবশিষ্টাংশগুলি ( Leu, Ile, Val, Phe, এবং Trp ) প্রোটিনের মাঝখানে সমাহিত থাকে, যেখানে হাইড্রোফিলিক পার্শ্ব শিকলগুলি জলীয় দ্রাবকের সংস্পর্শে আসে। (উল্লেখ্য যে প্রাণ-রসায়নে, "অবশিষ্টাংশ" (residue ) বলতে পলিস্যাকারাইড, প্রোটিন বা নিউক্লিক অ্যাসিডের পলিমেরিক শিকলের একটি নির্দিষ্ট মনোমারকে বোঝায়)। অবিচ্ছেদ্য ঝিল্লি প্রোটিনগুলির ক্ষেত্রে তাদের বাহ্যিক বলয়গুলি, উন্মুক্ত পানি-বিকর্ষী অ্যামিনো অ্যাসিডের হয় যা তাদের লিপিড দ্বি-স্তরে অবস্থান করে। কিছু পেরিফেরাল মেমব্রেন প্রোটিনের উপরিভাগে পানি-বিকর্ষী (হাইড্রোফোবিক) অ্যামিনো অ্যাসিডের একটি বিশেষ অংশ (patch) আছে যা ঝিল্লিতে আটকে থাকে। অনুরূপভাবে, যে প্রোটিনগুলিকে ধনাত্মক চার্জযুক্ত অণুর সাথে আবদ্ধ করতে হয় তাদের পৃষ্ঠতলগুলি গ্লুটামেট এবং অ্যাসপার্টেটের মতো ঋণাত্মক চার্জযুক্ত অ্যামিনো অ্যাসিড সমৃদ্ধ, অন্যদিকে ঋণাত্মক আধানযুক্ত অণুর সাথে আবদ্ধ প্রোটিনগুলির ধনাত্মক চার্জযুক্ত শিকল সমৃদ্ধ পৃষ্ঠ থাকে যেমনটা আছে লাইসিন এবং আরজিনিন এর ক্ষেত্রে ৷ উদাহরণস্বরূপ, লাইসিন এবং আরজিনিন, নিউক্লিক-অ্যাসিড বাইন্ডিং প্রোটিনের নিম্ন-জটিলতা-অঞ্চলে অত্যন্ত বেশী পরিমাণে থাকে। [২৭] অ্যামিনো অ্যাসিডের অবশিষ্টাংশের বিভিন্ন পানি-বিকর্ষী মাপন-ধাপ আছে। [২৮]
কিছু অ্যামিনো অ্যাসিডের বিশেষ বৈশিষ্ট্য আছে যেমন সিস্টাইন, যা অন্যান্য সিস্টাইনের অবশিষ্টাংশের সাথে সমযোজী ডাইসালফাইড বন্ধন তৈরি করতে পারে, প্রোলিন যা পলিপেপটাইড মেরুদন্ড কাঠামোর সাথে একটি চাক্রিক গঠন তৈরি করে এবং গ্লাইসিন যা অন্যান্য অ্যামিনো অ্যাসিডের চেয়ে (গঠনগত দিক হতে) বেশি নমনীয়।
এছাড়াও, ইউক্যারিওটিক এবং প্রোক্যারিওটিক প্রোটিনের নিম্ন-জটিলতা-অঞ্চলে গ্লাইসিন এবং প্রোলিন অত্যন্ত বেশী পরিমাণে থাকে, অন্যদিকে বিপরীত অবস্থাটি (নিম্ন-প্রতিনিধিত্ব) দেখা যায় অত্যন্ত ক্রিয়াশীল, বা জটিল, বা পানি-বিকর্ষী অ্যামিনো অ্যাসিডঅগুলির ক্ষেত্রে, যেমন সিস্টাইন, ফিনাইল অ্যালানিন, ট্রিপটোফ্যান, মেথিওনিন, ভ্যালিন, লিউসিন, আইসোলিউসিন। [২৭][২৯][৩০]
অনেক প্রোটিন কতিপয় রুপান্তরত্তোর পরিবর্তনের মধ্য দিয়ে যায়, যার ফলে কিছু অতিরিক্ত রাসায়নিক গ্রুপ অ্যামিনো অ্যাসিডের পার্শ্ব-শিকলের সাথে যুক্ত হয়। কিছু পরিবর্তন পানি-বিকর্ষী লিপোপ্রোটিন,[৩১] বা পানি-আকর্ষী গ্লাইকোপ্রোটিন তৈরি করতে পারে। [৩২] এই ধরনের পরিবর্তনগুলির কারণে একটি ঝিল্লিতে প্রোটিনের উভমুখী সংযোগ (reversible targeting) সম্ভবপর হয়। উদাহরণস্বরূপ, কিছু সংকেত প্রোটিনের (signaling proteins) সিস্টাইন অবশিষ্টাংশের সাথে, ফ্যাটি অ্যাসিড পালমিটিক অ্যাসিডের সংযোজন এবং অপসারণের ফলে প্রোটিনগুলিকে কোষ-ঝিল্লির সাথে প্রথমে সংযুক্ত করা এবং তারপরে থেকে বিচ্ছিন্ন করার অবস্থা তৈরি হয়। [৩৩]
আদর্শ অ্যামিনো অ্যাসিডসমূহের নাম-সংক্ষেপণ এবং বৈশিষ্ট্যের সারণী
যদিও এক-অক্ষরের প্রতিকগুলি টেবিলে অন্তর্ভুক্ত করা হয়েছে, IUPAC-IUBMB এর সুপারিশ মতে, "এক-অক্ষরের প্রতিকগুলির ব্যবহার দীর্ঘ ক্রমের যৌগগুলির তুলনায় সীমিত রাখা উচিত"।
অন্য আরো কিছু প্রকারের মধ্য দুটি অতিরিক্ত অ্যামিনো অ্যাসিড অন্তর্ভুক্ত যারা কোডন দ্বারা কোডকৃত এবং এদেরকে সাধারণত স্টপ কোডন হিসাবে ব্যাখ্যা করা হয়:
নির্দিষ্ট অ্যামিনো অ্যাসিড কোড ছাড়াও, প্লেসহোল্ডারগুলি এমনসব ক্ষেত্রে ব্যবহার করা হয় যেখানে পেপটাইড বা প্রোটিনের রাসায়নিক বা ক্রিস্টালোগ্রাফিক বিশ্লেষণ চূড়ান্তভাবে অবশিষ্টাংশের (residue) পরিচয় নির্ধারণ করতে পারে না। এগুলি "সংরক্ষিত প্রোটিন ক্রম" সারসংক্ষেপ প্রস্তুতির উদ্দেশ্যেও ব্যবহৃত হয়। অনুরূপ অবশিষ্টাংশের সেটগুলি নির্দেশ করার জন্য একক অক্ষরের ব্যবহার, ঠিক ডিজিনারেট ক্ষারগুলির জন্য সংক্ষিপ্ত কোড ব্যবহারের অনুরূপ।[৩৭][৩৮]
কখনও কখনও Xaa- এর পরিবর্তে Unk ব্যবহার করা হয়, কিন্তু এটি পরিপূর্ণ আদর্শ নয়।
স্টপ কোডন এর ক্ষেত্রে প্রোটিনের মিউটেশনের জন্য টের (Ter) বা * (termination থেকে উৎপন্ন) ব্যবহৃত হয়। এটি কোনভাবেই কোন অ্যামিনো অ্যাসিডকে নির্দেশ করে না। [৩৯]
উপরন্তু, অনেক অনাদর্শ অ্যামিনো অ্যাসিডের একটি নির্দিষ্ট কোড আছে। উদাহরণস্বরূপ, বোর্টেজোমিব এবং MG132- এর মতো বেশ কিছু পেপটাইড ওষুধ কৃত্রিমভাবে সংশ্লেষিত হয় এবং তারা তাদের নির্দিষ্ট কোডযুক্ত প্রোটেক্টিং গ্রুপগুলিকে অক্ষুন্ন রাখে। Bortezomib হল Pyz –Phe–boroLeu, এবং MG132 হল Z –Leu–Leu–Leu–al। প্রোটিন-গঠন বিশ্লেষণে সহায়তাকারী হিসেবে ফটো-রিঅ্যাকটিভ অ্যামিনো অ্যাসিড অ্যানালগ বেশ সুলভ। এর মধ্যে রয়েছে ফটোলিউসিন ( pLeu ) এবং ফটোমেথিওনিন ( pMet )। [৪০]
Remove ads
প্রাণ-রসায়নে প্রাপ্তিতা এবং কার্যাবলী
সারাংশ
প্রসঙ্গ
A polypeptide is an unbranched chain of amino acids
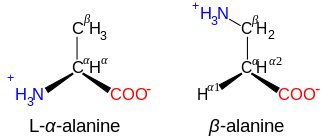
β-Alanine and its α-alanine isomer
The amino acid selenocysteine
কার্বক্সিল গ্রুপের পাশে (আলফা-) কার্বন পরমাণুর সাথে অ্যামাইন গ্রুপ যুক্ত অ্যামিনো অ্যাসিডগুলির বিশেষ গুরুত্ব রয়েছে। এগুলি 2-, আলফা- বা α-অ্যামিনো অ্যাসিড নামে পরিচিত (বেশীরভাগ ক্ষেত্রে সাধারণ সংকেত H2NCHRCOOH যেখানে R হল একটি জৈব প্রতিস্থাপক যা " পার্শ্ব চেইন " নামে পরিচিত);[৪১] তবে, প্রায়শই "অ্যামিনো অ্যাসিড" শব্দটি বিশেষভাবে এগুলোর জন্য ব্যবহৃত হয়। এর মধ্যে রয়েছে 22টি প্রোটিনোজেনিক ("প্রোটিন-বিল্ডিং") অ্যামিনো অ্যাসিড,[৪২][৪৩][৪৪] যা পেপটাইড চেইনে ("পলিপেপটাইড") একত্রিত হয়ে প্রোটিনের বিশাল বিন্যাসের গাঠনিক ব্লকসমূহ তৈরি করে। [৪৫] এগুলি সবই এল - স্টেরিওআইসোমার (" বাম-হাতি/ঘূর্ণী " অ্যানানশিওমার ), যদিও কিছু ডি -অ্যামিনো অ্যাসিড ("ডান-হাতি/ঘূর্ণী") ব্যাকটেরিয়গত পর্দায় (bacterial envelopes), নিউরোমোডুলেটর ( ডি - সেরিন ) হিসাবে এবং কিছু অ্যান্টিবায়োটিক পদার্থে দেখা যায়। [৪৬]
অনেক প্রোটিনোজেনিক এবং অ-প্রোটিনোজেনিক অ্যামিনো অ্যাসিড বিভিন্ন জৈবিক কার্যাবলী সম্পাদন করে। উদাহরণস্বরূপ, মানুষের মস্তিষ্কে, গ্লুটামেট (আদর্শ গ্লুটামিক অ্যাসিড ) এবং গামা -অ্যামিনোবুটারিক অ্যাসিড ("GABA", অনাদর্শ গামা-অ্যামিনো অ্যাসিড) যথাক্রমে প্রধান উত্তেজক এবং প্রতিরোধক নিউরোট্রান্সমিটার হিসেবে কাজ করে। [৪৭] হাইড্রোক্সিপ্রোলিন, সংযোগকারী টিস্যু কোলাজেনের একটি প্রধান উপাদান যা প্রোলিন থেকে সংশ্লেষিত হয়। গ্লাইসিন হল লাল রক্তকণিকায় ব্যবহৃত পোরফাইরিনের একটি জৈব-সংশ্লেষী অগ্রদূত। কার্নিটাইন লিপিড পরিবহনে ব্যবহৃত হয়। নয়টি প্রোটিনোজেনিক অ্যামিনো অ্যাসিডকে মানুষের জন্য "অত্যাবশ্যক" বলা হয় কারণ সেগুলি অন্যান্য যৌগ হতে মানবদেহ কর্তৃক তৈরি করা সম্ভব হয় না এবং সেহেতু এগুলোকে খাদ্য হিসাবে গ্রহণ করা আবশ্যক। অন্যগুলি নির্দিষ্ট বয়স বা চিকিৎসাগত অবস্থার পরিপ্রেক্ষিতে শর্তসাপেক্ষে অপরিহার্য হতে পারে। অপরিহার্য অ্যামিনো অ্যাসিডও প্রকার থেকে প্রকারান্তরে পরিবর্তিত হতে পারে। তাদের জৈবিক তাৎপর্যের কারণে, অ্যামিনো অ্যাসিডগুলি পুষ্টিতে গুরুত্বপূর্ণ এবং সাধারণত পুষ্টি- সম্পূরক পদার্থ , সার, ফিড এবং খাদ্য প্রযুক্তিতে ব্যবহৃত হয়। এছাড়া, ওষুধের উৎপাদন, বায়োডিগ্রেডেবল প্লাস্টিক এবং কাইরাল অনুঘটক হিসেবে এগুলো শিল্পক্ষেত্রে ব্যবহৃত হয় ।
প্রোটিনোজেনিক অ্যামিনো অ্যাসিড সমূহ
অ্যামিনো অ্যাসিডগুলি প্রোটিন তৈরির অগ্রদূত। ঘনীভবন বিক্রিয়ার মাধ্যমে এরা পরস্পর সংযুক্ত হয়ে পেপটাইড নামে ছোট পলিমার শিকল অথবা পলিপেপটাইড বা প্রোটিন নামে লম্বা শিকল তৈরি করে। এই শিকলগুলি সরলরৈখিক এবং শাখাবিহীন, যেখানে শিকল মধ্যস্থ প্রতিটি অ্যামিনো অ্যাসিডের অবশিষ্টাংশ পার্শ্বস্থ দুটি অ্যামিনো অ্যাসিডের সাথে সংযুক্ত থাকে। প্রকৃতিতে, ডিএনএ/আরএনএ জেনেটিক উপাদান দ্বারা কোডকৃত প্রোটিন তৈরির প্রক্রিয়াটিকে ট্রান্সলেশন (অনুলিপন) বলা হয় এবং এ প্রক্রিয়াটিতে রাইবোসোম নামক রাইবোজাইম (এক ধরনের এনজাইম) দ্বারা ক্রমবর্ধমান প্রোটিন শিকলের সাথে অ্যামিনো অ্যাসিডের ধাপে ধাপে সংযোজন ঘটে। [৪৮] যে ক্রমে অ্যামিনো অ্যাসিড যোগ করা হয় তা mRNA ছাঁচ (template) থেকে জেনেটিক কোডের মাধ্যমে পড়া যায়, যা জীবাণুর জিনের একটি RNA অনুলিপি।
প্রাকৃতিকভাবে প্রাপ্ত বাইশটি অ্যামিনো অ্যাসিডকে পলিপেপটাইডে অন্তর্ভুক্ত করা হয়েছে এবং এদেরকে প্রোটিনোজেনিক বা প্রাকৃতিক অ্যামিনো অ্যাসিড বলা হয়। [২১] এদের মধ্যথেকে, 20টি সার্বজনীন জেনেটিক কোড দ্বারা কোডকৃত। অবশিষ্ট 2 টি যথা, সেলেনোসিস্টাইন এবং পাইরোলাইসিন কে অসাধারণ সংশ্লেষণী কলাকৌশল (unique synthetic mechanisms) দ্বারা প্রোটিনের অন্তর্ভুক্ত করা হয়েছে। mRNA- এর ট্রান্সলেশনের সময় সেলেনোসিস্টাইন এর অন্তর্ভুক্তিতে SECIS উপাদানও জড়িত থাকে, যার ফলে স্টপ কোডনের পরিবর্তে UGA কোডন দ্বারা সেলেনোসিস্টাইনকে কোড করা হয়। [৪৯] এনজাইমগুলিতে কিছু মিথেনোজেনিক আর্কিয়া (methanogenic archaea) কর্তৃক পাইরোলাইসিন ব্যবহৃত হয়, যা তারা মিথেন তৈরিতে ব্যবহার করে। এটি কোডন UAG দিয়ে কোড করা হয়, যা সাধারণত অন্যান্য জীবাণুর ক্ষেত্রে একটি স্টপ কোডন। [৫০] এই UAG কোডনটি PYLIS ডাউনস্ট্রিম সিকোয়েন্স কর্তৃক অনুসৃত হয়। [৫১]
বেশ কিছু স্বাধীন বিবর্তনমূলক গবেষণায় বলা হয়েছে যে, Gly, Ala, Asp, Val, Ser, Pro, Glu, Leu, Thr- এগুলি অ্যামিনো অ্যাসিডের একটি গ্রুপে অন্তর্ভুক্ত হতে পারে যাদের প্রাথমিক জেনেটিক কোড তারা গঠন করেছিল, অন্যদিকে Cys, Met, Tyr, Trp, His, Phe- এগুলি অন্তর্গত হতে পারে অ্যামিনো অ্যাসিডের সেই গ্রুপে যারা জেনেটিক কোডের পরবর্তী সংযোজনের ক্ষেত্রে গঠনগত ভূমিকা রেখেছিল। [২৭][৫২][৫৩][৫৪][৫৫]
আদর্শ (প্রমাণ) বনাম অনাদর্শ (অপ্রমাণ) অ্যামিনো অ্যাসিড সমূহ
সার্বজনীন জেনেটিক কোডের কোডন দ্বারা সরাসরি কোড করা 20টি অ্যামিনো অ্যাসিডকে আদর্শ বা নিয়মবদ্ধ (standard or canonical) অ্যামিনো অ্যাসিড বলা হয়। ব্যাকটেরিয়া, মাইটোকন্ড্রিয়া এবং ক্লোরোপ্লাস্টে প্রোটিনের প্রাথমিক অ্যামিনো অ্যাসিড হিসাবে মেথিওনিনের জায়গায় মেথিওনিনের একটি পরিবর্তিত রূপ প্রায়ই ব্যবহৃত হয়। অন্যান্য অ্যামিনো অ্যাসিডগুলিকে বলা হয় অনাদর্শ বা অ-নিয়মবদ্ধ। বেশিরভাগ অনাদর্শ অ্যামিনো অ্যাসিডগুলিও অ-প্রোটিনোজেনিক (অর্থাৎ ট্রান্সলেশনের সময় এগুলিকে প্রোটিনের অন্তর্ভুক্ত করা যায় না), তবে তাদের মধ্যে দুটি প্রোটিনোজেনিক, কারণ সার্বজনীন জেনেটিক কোডে কোডকৃত নয় এমন তথ্য কাজে লাগিয়ে এদেরকে ট্রান্সলেশনগত দিক থেকে প্রোটিনের অন্তর্ভুক্ত করা যেতে পারে।
দুটি অনাদর্শ প্রোটিনোজেনিক অ্যামিনো অ্যাসিড হল সেলেনোসিস্টাইন (অনেক নন-ইউক্যারিওট এবং বেশিরভাগ ইউক্যারিওটে উপস্থিত, কিন্তু ডিএনএ দ্বারা সরাসরি কোড করা হয় না) এবং পাইরোলাইসিন (শুধুমাত্র কিছু আর্কিয়া এবং অন্তত একটি ব্যাকটেরিয়াতে পাওয়া যায়)। এই অনাদর্শ অ্যামিনো অ্যাসিডগুলির অন্তর্ভুক্তি বিরল। উদাহরণস্বরূপ, 25টি মানব প্রোটিনের প্রাথমিক কাঠামোতে সেলেনোসিস্টাইন আছে,[৫৬] এবং গাঠনিক দিক থেকে বৈশিষ্ট্যপূর্ণ এনজাইমগুলি (যেমন, সেলেনোএনজাইম ) তাদের সক্রিয় সাইটগুলিতে অনুঘটকীয় ক্ষুদ্রাংশ হিসাবে সেলেনোসিস্টাইনকে নিয়োজিত রাখে। [৫৭] পাইরোলাইসিন এবং সেলেনোসিস্টাইন এ দুটিকে বিকল্প কোডনগুলির মাধ্যমে কোড করা হয়। উদাহরণস্বরূপ, সেলেনোসিস্টাইনকে স্টপ কোডন এবং SECIS উপাদান দ্বারা কোড করা হয়। [৫৮][৫৯]
এন-ফরমাইলমেথিওনাইনকে (যা প্রায়শই ব্যাকটেরিয়া, মাইটোকন্ড্রিয়া এবং ক্লোরোপ্লাস্টের প্রোটিনের প্রারম্ভিক অ্যামিনো অ্যাসিড হয়ে থাকে) সাধারণত মেথিওনিনের একটি রূপ হিসাবে বিবেচনা করা হয়- পৃথক প্রোটিনোজেনিক অ্যামিনো অ্যাসিড হিসেবে নয়। কডন– tRNA সংমিশ্রণগুলি প্রকৃতিতে পাওয়া যায় না, জেনেটিক কোডকে "সম্প্রসারিত" করতে এবং অ্যালোপ্রোটিন নামে পরিচিত একটি অভিনব প্রোটিন তৈরি করতে এগুলো ব্যবহৃত হয় যেটি (অ্যালোপ্রোটিন) আবার অপ্রোটিনোজেনিক অ্যামিনো অ্যাসিডকে অন্তর্ভুক্ত করে, । [৬০][৬১][৬২]
অ-প্রোটিনোজেনিক অ্যামিনো অ্যাসিড
22টি প্রোটিনোজেনিক অ্যামিনো অ্যাসিড ছাড়াও, অনেক অ-প্রোটিনোজেনিক অ্যামিনো অ্যাসিড আমাদের পরিচিত। সেগুলি প্রোটিনে হয় পাওয়া যায় না (উদাহরণস্বরূপ কার্নিটাইন, GABA, লেভোথাইরক্সিন ) অথবা সেগুলি সরাসরি এবং আলাদাভাবে প্রমিত কোষীয় যন্ত্রপাতি দ্বারা তৈরি করা যায় না (যেমন, হাইড্রক্সিপ্রোলিন এবং সেলেনোমেথিওনিন )।
প্রোটিনে পাওয়া অ-প্রোটিনোজেনিক অ্যামিনো অ্যাসিডগুলি ট্রান্সলেশন-পরবর্তী পরিবর্তনের মধ্য দিয়ে গঠিত হয়, যে পরিবর্তনটি মূলত প্রোটিন সংশ্লেষণের সময় ট্রান্সলেশনের পরে ঘটে। এই পরিবর্তনগুলি প্রায়ই প্রোটিনের কার্য বা নিয়ন্ত্রণের জন্য অপরিহার্য। উদাহরণস্বরূপ, গ্লুটামেটের কার্বক্সিলেশন ক্যালসিয়াম ক্যাটায়নেগুলোকে আরও ভালোভাবে বাইন্ডিংয়ের সুযোগ করে দেয়,[৬৩] এবং কোলাজেনে হাইড্রোক্সিপ্রোলিন থাকে যা প্রোলিনের হাইড্রোক্সিলেশনের মাধ্যমে তৈরি হয়। [৬৪] আরেকটি উদাহরণ হল, ট্রান্সলেশন সূচনা ফ্যাক্টর (translation initiation factor ) EIF5A তে লাইসিন অবশিষ্টাংশের সামান্য পরিবর্তনের মাধ্যমে হাইপুসিনের গঠন। [৬৫] এই ধরনের পরিবর্তনগুলি প্রোটিনের অসঞ্চরণশীলতাও (localization) নির্ধারণ করে থাকে, যেমন, দীর্ঘ পানি-বিকর্ষী গ্রুপ যুক্ত করার কারণে একটি ফসফোলিপিড ঝিল্লির সাথে প্রোটিন বাইন্ড হতে পারে। [৬৬]
কিছু অ-প্রোটিনোজেনিক অ্যামিনো অ্যাসিড প্রোটিনে পাওয়া যায় না। এরকম উদাহরণগুলির মধ্যে আছে, 2-অ্যামিনোআইসোবিউটারিক অ্যাসিড এবং গামা-অ্যামিনোবুটারিক অ্যাসিড (gamma-aminobutyric acid) নামে নিউরোট্রান্সমিটার। অ-প্রোটিনোজেনিক অ্যামিনো অ্যাসিডগুলি প্রায়শই বিপাকীয় পথগুলিতে অন্তর্বর্তী যৌগ হিসাবে কাজ করে – উদাহরণস্বরূপ, অরনিথিন এবং সিট্রুলাইন ইউরিয়া চক্রে পাওয়া যায় যা মূলতঃ অ্যামিনো অ্যাসিড ক্যাটাবলিজমের অংশ (নীচে দেখুন)। [৬৭] জীববিজ্ঞানে α-অ্যামিনো অ্যাসিডের প্রাধান্য বিস্তারের একটি বিরল ব্যতিক্রম হল β-অ্যামিনো অ্যাসিড বিটা অ্যালানাইন (3-অ্যামিনোপ্রোপানোইক অ্যাসিড), যা প্যান্টোথেনিক অ্যাসিড (ভিটামিন বি 5 ) এর সংশ্লেষণের সময় উদ্ভিদ এবং অণুজীবের মধ্যে ব্যবহৃত হয় এবং এটি হলো কোএনজাইম এ এর একটি উপাদান। [৬৮]
মানব পুষ্টিতে (অ্যামিনো অ্যাসিড)

যখন খাদ্য থেকে অ্যামিনো অ্যাসিডগুলি মানবদেহে গৃহীত হয়, তখন 20টি প্রমাণ অ্যামিনো অ্যাসিড হয় প্রোটিন, অন্যান্য প্রাণ-অণু সংশ্লেষণে ব্যবহৃত হয়, অথবা শক্তির উৎস হিসাবে ইউরিয়া এবং কার্বন ডাই অক্সাইডে জারিত করা হয়। [৬৯] ট্রান্সমিনেজ দ্বারা অ্যামিনো গ্রুপ অপসারণের মাধ্যমে এই জারণ ক্রিয়া শুরু হয়; এরপর অ্যামিনো গ্রুপকে ইউরিয়া চক্রে প্রবেশ করানো হয়। ট্রান্স-অ্যামিডেশনের (transamidation) অন্য উৎপাদটি হল কেটো অ্যাসিড যা সাইট্রিক অ্যাসিড চক্রে প্রবেশ করে। [৭০] গ্লুকোনোজেনেসিসের মাধ্যমে গ্লুকোজেনিক অ্যামিনো অ্যাসিডও গ্লুকোজে রূপান্তরিত হতে পারে। [৭১] 20টি প্রমাণ অ্যামিনো অ্যাসিডের মধ্যে, নয়টি ( His, Ile, Leu, Lys, Met, Phe, Thr, Trp এবং Val ) কে অত্যাবশ্যক অ্যামিনো অ্যাসিড বলা হয়, কারণ মানবদেহের স্বাভাবিক বৃদ্ধির জন্য যে পরিমাণে সেগুলো প্রয়োজন, সেই পরিমাণে অন্যান্য যৌগ থেকে মানবদেহ তাদের সংশ্লেষণ করতে পারে না, আর, সেকারণেই এগুলোকে খাদ্য থেকে গ্রহণ করা অত্যাবশ্যক। [৭২][৭৩][৭৪] উপরন্তু, সিস্টাইন (cysteine), টাইরোসিন এবং আরজিনাইনকে (arginine) আধা-অত্যাবশ্যক অ্যামিনো অ্যাসিড হিসেবে বিবেচনা করা হয় এবং শিশুদের ক্ষেত্রে টরিনকে বিবেচনা করা হয় একটি আধা-অত্যাবশ্যক অ্যামিনো সালফোনিক অ্যাসিড হিসাবে। যে বিপাকীয় প্রক্রিয়ায় এই মনোমারগুলিকে সংশ্লেষিত হয় সেই বিক্রিয়া-পথগুলি পূর্ণরুপে বিকশিত নয়। [৭৫][৭৬] (দেহের জন্য অ্যামিনো অ্যাসিডের) প্রয়োজনীয় পরিমাণ, ব্যক্তির বয়স এবং স্বাস্থ্যের উপরও নির্ভর করে, তাই কতিপয় অ্যামিনো অ্যাসিডের জন্য খাদ্যতালিকাগত চাহিদা (dietary requirement) নির্ণয়ের ক্ষেত্রে সাধারণ বিবৃতি তৈরি করা কঠিন। অ-প্রমাণক অ্যামিনো অ্যাসিড যেমন, BMAA এর প্রতি খাদ্যতালিকাগত ঝোঁকের বিষয়টিকে (Dietary exposure), ALS সহ মানুষের নিউরোডিজেনারেটিভ রোগের সাথে সম্বন্ধযুক্ত করা হয়েছে। [৭৭][৭৮]


সংক্ষেপণ এবং উপস্থাপনা:
- PLD: ফসফোলিপেজ D
- PA: ফসফেটিডিক অ্যাসিড
- MTOR: র্যাপামাইসিন এর কলাকৌশলগত লক্ষ্যবস্তু (target)
- AMP: অ্যাডেনোসিন মনোফসফেট
- ATP: অ্যাডেনোসিন ট্রাইফসফেট
- AMPK: এএমপি-সক্রিয়িত প্রোটিন কাইনেজ
- PGC 1α: peroxisome proliferator সক্রিয়িত রিসেপ্টর গামা কোঅ্যাকটিভেটর-1α
- S6K1: p70S6 কাইনেজ
- 4EBP1: ইউক্যারিওটিক ট্রান্সলেশন সূচক ফ্যাক্টর 4E-বাইন্ডিং প্রোটিন 1
- EIF4E: ইউক্যারিওটিক ট্রান্সলেশন সূচক ফ্যাক্টর 4E
- RPS6: রাইবোসোমাল প্রোটিন S6
- eEF2: ইউক্যারিওটিক প্রলম্বন ফ্যাক্টর 2
- RE: প্রতিরোধের অনুশীলন; EE: সহনশীলতা অনুশীলন
- Myo: মায়োফাইব্রিলার; মাইটো: মাইটোকন্ড্রিয়াল
- AA: অ্যামিনো অ্যাসিড
- HMB: β-হাইড্রক্সি β-মিথাইলবুটিরিক অ্যাসিড
- ↑ অ্যাক্টিভেশন প্রতিনিধিত্ব করে
- Τ বাধা প্রতিনিধিত্ব করে
অ্যামিনো অ্যাসিডের অ-প্রোটিন কার্যাবলী
মানুষের মস্তিষ্কে ক্যাটেকোলামিন (Catecholamine) এবং ট্রেস অ্যামিন (Trace amine) তৈরির বায়োসিন্থেটিক পথ

মানুষের মধ্যে, অ-প্রোটিন অ্যামিনো অ্যাসিডেরও বিপাকীয় মধ্যক (বিপাকীয় মধ্যবর্তী যৌগ) হিসাবে গুরুত্বপূর্ণ ভূমিকা রয়েছে, যেমনটা দেখা যায় নিউরোট্রান্সমিটার গামা-অ্যামিনোবুটারিক অ্যাসিড (GABA) এর প্রাণ (রাসায়নিক) সংশ্লেষণে। অন্য আরো অ্যামিনো অ্যাসিড অন্যান্য অণু সংশ্লেষণ করতে ব্যবহৃত হয়, উদাহরণস্বরূপ:
- ট্রিপটোফান হল নিউরোট্রান্সমিটার সেরোটোনিনের অগ্রদূত।[৮২]
- টাইরোসিন (এবং এর পূর্বসূরি ফেনিল্যালানাইন) হল ক্যাটেকোলামাইন নিউরোট্রান্সমিটার ডোপামিন, এপিনেফ্রাইন এবং নোরপাইনফ্রাইন এবং বিভিন্ন ট্রেস অ্যামাইনের অগ্রদূত।
- ফেনিল্যালানাইন মানুষের মধ্যে ফেনিথিলামাইন এবং টাইরোসিনের অগ্রদূত। উদ্ভিদের মধ্যে, এটি বিভিন্ন ফিনাইলপ্রোপ্যানয়েডের অগ্রদূত, যা উদ্ভিদ বিপাকের ক্ষেত্রে গুরুত্বপূর্ণ।
- গ্লাইসিন হল হেমের মতো পোরফাইরিনের অগ্রদূত। [৮৩]
- আর্জিনাইন নাইট্রিক অক্সাইডের অগ্রদূত। [৮৪]
- অর্নিথাইন এবং এস -এডেনোসিলমেথিওনিন হল পলিমাইনের অগ্রদূত । [৮৫]
- অ্যাসপার্টেট, গ্লাইসিন এবং গ্লুটামিন হল নিউক্লিওটাইডের পূর্বসূরী।[৮৬] যাইহোক, অন্যান্য সুপ্রচুর অ-প্রমাণ অ্যামিনো অ্যাসিডের সকল কার্যাবলী সম্পর্কে জানা যায় না।
কিছু অপ্রমাণ অ্যামিনো অ্যাসিড উদ্ভিদে তৃণভোজীদের বিরুদ্ধে প্রতিরক্ষা হিসাবে ব্যবহৃত হয়।[৮৭] উদাহরণ স্বরূপ, ক্যানাভানাইন হল আর্জিনাইনের একটি অ্যানালগ যা অনেক লেগিউম জাতীয় উদ্ভিদে পাওয়া যায়,[৮৮] এবং বিশেষ করে ক্যানাভালিয়া গ্ল্যাডিয়াটাতে (Canavalia gladiata) (তলোয়ার বিন ) প্রচুর পরিমাণে পাওয়া যায়। [৮৯] এই অ্যামিনো অ্যাসিড গাছগুলিকে শিকারীদের যেমন, পোকামাকড় থেকে রক্ষা করে এবং কতিপয় লেগিউম এমন যে, যদি প্রক্রিয়াজাত না করে খাওয়া হয় তবে তা মানুষের ক্ষেত্রে অসুস্থতা সৃষ্টি করতে পারে। [৯০] মিমোসিন একটি অ-প্রোটিন অ্যামিনো অ্যাসিড যা অন্যান্য প্রজাতির লেগিউমে পাওয়া যায়, বিশেষ করে লিউকেনা লিউকোসেফালা তে।[৯১] এই যৌগটি টাইরোসিনের একটি অ্যানালগ এবং যেসব জীবজন্তু চড়াকালীন সময় এসব উদ্ভিদ খায়, এটি তাদের শরীরে বিষক্রিয়া তৈরি করতে পারে।
Remove ads
শিল্পক্ষেত্রে ব্যবহার
সারাংশ
প্রসঙ্গ
অ্যামিনো অ্যাসিডগুলির ব্যবহার শিল্পে বহুমাত্রিক, তবে তাদের মুখ্য ব্যবহার পশু খাদ্যের (খাদ্য) সংযোজনী (additives) হিসাবে। এমনটি দরকারী, কেননা এই পশুখাদ্যগুলির অনেক সিংহ উপাদানে (bulk components), যেমন সয়াবিন, অত্যাবশ্যক অ্যামিনো অ্যাসিডগুলি হয় কম মাত্রায় থাকে অথবা থাকেই না: লাইসিন, মেথিওনিন, থ্রিওনিন এবং ট্রিপটোফ্যান এই অ্যামিনো অ্যাসিডগুলি এসব পশুখাদ্য উৎপাদনের ক্ষেত্রে খুবই গুরুত্বপূর্ণ। [৯২] শিল্পক্ষেত্রে, পরিপূরক খাবার (supplements) থেকে খনিজের শোষণ প্রক্রিয়াকে উন্নীত করতে অ্যামিনো অ্যাসিডগুলি ব্যবহৃত হয় যেক্ষেত্রে তারা ধাতব আয়নগুলির সাথে চিলেট যৌগ তৈরি করে- খনিজের শোষণ এই প্রক্রিয়া প্রাণীদের স্বাস্থ্য বা উৎপাদনশীলতা উন্নীতকরণে বিশেষভাবে প্রয়োজনীয় হতে পারে। [৯৩]
খাদ্য শিল্পও অ্যামিনো অ্যাসিডের একটি প্রধান ভোক্তা, এক্ষেত্রে বিশেষভাবে উল্লেখযোগ্য হলো গ্লুটামিক অ্যাসিড, যা সুগন্ধ/স্বাদ বৃদ্ধিকারী হিসাবে ব্যবহৃত হয়,[৯৪] এবং অ্যাসপার্টাম (অ্যাসপার্টাফিনাইলঅ্যালানিন 1-মিথাইল এস্টার) যা কম-ক্যালোরিযুক্ত [[কৃত্রিম উৎকোচ|কৃত্রিম মিষ্টিকারক]] হিসাবে ব্যবহৃত হয়। [৯৫] প্রাণী পুষ্টির ক্ষেত্রে ব্যবহৃত প্রযুক্তির অনুরূপ প্রযুক্তি মানব পুষ্টি শিল্পেও ব্যবহার করা হয় এবং খনিজ শোষণ প্রক্রিয়াকে উন্নীতকরণ এবং অজৈব খনিজ পরিপূরক (খাবার) সৃষ্ট নেতিবাচক পার্শ্বপ্রতিক্রিয়াগুলো কমানোর মাধ্যমে তা (মানব শরীরে) খনিজ ঘাটিত জনিত উপসর্গগুলির যেমন, রক্তশূন্যতা উপশমে এরুপ প্রযুক্তি অবদান রাখে। [৯৬]
কৃষিতে ব্যবহৃত সারে অ্যামিনো অ্যাসিডগুলির চিলেটিং (chelating) সক্ষমতা ব্যবহার করা হয় এ উদ্দেশ্যে যে, তা উদ্ভিদে খনিজ সরবরাহকে ত্বরাণ্বিত করবে যেন আয়রন ক্লোরোসিসের মতো খনিজ ঘাটতিজনিত ব্যাপারগুলির সঠিক সমাধান হয়। এই সারগুলি (খনিজ) ঘাটতিজনিত ব্যাপারগুলির ঘটতে থাকা নিরোধকল্পে এবং উদ্ভিদের সামগ্রিক স্বাস্থ্যের উন্নতি করতেও ব্যবহৃত হয়। [৯৭] এছাড়া, অ্যামিনো অ্যাসিডের অন্যান্য উৎপাদন গত ব্যবহারের মধ্যে ওষুধ এবং প্রসাধনী সামগ্রীর সংশ্লেষণ অন্তর্ভুক্ত। [৯২]
অনুরুপভাবে, কিছু অ্যামিনো অ্যাসিড-জাত যৌগ (derivatives) ঔষধ শিল্পে ব্যবহৃত হয়। এর মধ্যে আছে 5-HTP (5-hydroxytryptophan) যা বিষন্নতার পরীক্ষামূলক চিকিৎসায় ব্যবহৃত হয়।[৯৮] L-DOPA ( L -dihydroxyphenylalanine), পারকিনসন্সের চিকিৎসার জন্য,[৯৯] এবং এফলরনিথিন ঔষধ যা অরনিথিন ডিকার্বক্সাইলেজ (ornithine decarboxylase) কে বাধা দেয় এবং ঘুমের অসুস্থতার চিকিৎসায় ব্যবহৃত হয়।[১০০]
সম্প্রসারিত জেনেটিক কোড
২০০১ সাল থেকে, 40টি অ-প্রাকৃতিক অ্যামিনো অ্যাসিডকে প্রোটিনের অন্তর্ভুক্ত করা হয়েছে একটি অনন্য কোডন (রিকোডিং) এবং একটি সংশ্লিষ্ট স্থানান্তর-RNA দ্বারা: (এটি হলো একটি) অ্যামিনোঅ্যাসাইল tRNA সিন্থেটেজ যুগল যা দ্বারা এটিকে বিভিন্ন ভৌত রাসায়নিক এবং জৈবিক বৈশিষ্ট্যের সাথে এনকোড করা হয় যেন এর মাধ্যমে প্রোটিনের গঠন এবং কার্যকারিতা অন্বেষণ করা অথবা নতুন বা উন্নত প্রোটিন তৈরির একটি হাতিয়ার হিসাবে এটিকে ব্যবহার করা যায়।[৬০][৬১]
নুলোমারস (Nullomers)
নুলোমারস হল কোডন যা তাত্ত্বিকভাবে অ্যামিনো অ্যাসিডের জন্য একটি কোড, তবে, প্রকৃতিতে এই কোডনটি অন্যের ক্ষেত্রে যেন ব্যবহৃত না হয় (বিরুদ্ধ ব্যবহার) সে ব্যাপারে একটি পছন্দসই পক্ষপাত (selective bias) আছে, উদাহরণস্বরূপ ব্যাকটেরিয়া আরজিনিনের কোডে AGA এর পরিবর্তে CGA ব্যবহার করতে পছন্দ করে।[১০১] এটি এমন কিছু সিকোয়েন্স তৈরি করে যা জিনোমে দেখা যায় না। এই বিশেষ বৈশিষ্ট্যটি একটি সুবিধার বিষয় বটে যা নতুন, নির্দিষ্ট (কার্যভিত্তিক) ক্যান্সারের বিরুদ্ধে লড়াইকারী ওষুধ তৈরিতে,[১০২] এবং অপরাধ-এলাকার (crime-scene ) তদন্ত কার্যাবলী থেকে প্রাপ্ত ডিএনএ নমুনাগুলির আড়াআড়ি-দূষণ প্রতিরোধ করতে ব্যবহৃত হতে পারে। [১০৩]
রাসায়নিক গাঠনিক ব্লক হিসেবে অ্যামিনো অ্যাসিড সমূহ
সস্তা কাঁচামাল হিসেবে অ্যামিনো অ্যাসিডসমূহ গুরুত্বপূর্ণ। এই যৌগগুলি কাইরাল পুল সংশ্লেষণে এনানশিওমারগত গাঠনিক ব্লক হিসাবে ব্যবহৃত হয়। [১০৪]
অ্যামিনো অ্যাসিডগুলিকে কাইরাল অনুঘটক যৌগের অগ্রদূত হিসাবে পরীক্ষা-নিরীক্ষা করা হয়েছে, যেমনটা ঘটেছে অপ্রতিসম হাইড্রোজেনেশন বিক্রিয়ার ক্ষেত্রে, যদিও এসবের কোন বাণিজ্যিক প্রয়োগ নেই। [১০৫]
জীবাণুবিয়োজ্য (Biodegradable) প্লাস্টিক হিসেবে অ্যামিনো অ্যাসিড সমূহ
অ্যামিনো অ্যাসিডগুলিকে জীবাণুবিয়োজ্য পলিমারের উপাদান হিসাবে বিবেচনা করা হয়, যার প্রয়োগ পরিবেশ বান্ধব মোড়কজাতকরণ এবং ওষুধের ঔষধ বিতরণকার্যে এবং কৃত্রিম ইমপ্লান্ট নির্মাণে দেখা যায়। [১০৬] এই জাতীয় উপকরণগুলির একটি কৌতূহলোদ্দীপক উদাহরণ হল পলিআস্পার্টেট যা হলো পানিতে-দ্রবণীয় একটি জীবাণুবিয়োজ্য পলিমার এবং যেটির প্রয়োগ পরিত্যাজ্য (disposable) ডায়াপার এবং কৃষিতে থাকতে পারে। [১০৭] পলিআস্পার্টেটের দ্রবণীয়তা এবং ধাতব আয়ন চিলেট তৈরির ক্ষমতার কারণে এটি জীবাণুবিয়োজ্য অ্যান্টি স্কেলিং এজেন্ট এবং (ধাতু বা সংকর যৌগের) ক্ষয় প্রতিরোধক হিসাবেও ব্যবহৃত হচ্ছে। [১০৮][১০৯] উপরন্তু, পলিকার্বনেট তৈরিতে অ্যারোমেটিক অ্যামিনো অ্যাসিড টাইরোসিনকে (পলিকার্বনেটtyrosine) ফেনোলের সম্ভাব্য প্রতিস্থাপনীয় বিকল্প যেমন, বিসফেনল এ হিসাবে বিবেচনা করা হয়। [১১০]
Remove ads
সংশ্লেষণ
সারাংশ
প্রসঙ্গ

রাসায়নিক সংশ্লেষণ
অ্যামিনো অ্যাসিডের বাণিজ্যিক উৎপাদন সাধারণত মিউট্যান্ট ব্যাকটেরিয়াগুলির উপর নির্ভরশীল যারা কার্বনের উৎস হিসাবে গ্লুকোজ ব্যবহারের মাধ্যমে এক একটি অ্যামিনো অ্যাসিডের মাত্রাতিরিক্ত উৎপাদন ঘটায়। কিছু অ্যামিনো অ্যাসিড সাংশ্লেষণিক মধ্যবর্তী যৌগসমূহের ( synthetic intermediates) এনজাইমেটিক রূপান্তর দ্বারা উৎপাদিত হয়। উদাহরণস্বরূপ, ২-অ্যামিনোথিয়াজোলিন-৪-কারবক্সিলিক অ্যাসিড হল এল -সিস্টাইনের একটি বাণিজ্যিক সংশ্লেষণের মধ্যবর্তী যৌগ (মধ্যক)। লাইয়েজ (lyase) ব্যবহারের মাধ্যমে ফিউমারেটে অ্যামোনিয়া যোগ করে করে অ্যাসপার্টিক অ্যাসিড উৎপন্ন করা হয়। [১১১]
জৈব সংশ্লেষণ
উদ্ভিদের ক্ষেত্রে, নাইট্রোজেন প্রথমে গ্লুটামেট আকারে জৈব যৌগগুলিতে আত্মীকৃত হয়, যা মাইটোকন্ড্রিয়নে আলফা-কিটোগ্লুটারেট এবং অ্যামোনিয়া থেকে গঠিত হয়। অন্যান্য অ্যামিনো অ্যাসিডের ক্ষেত্রে, উদ্ভিদসমূহ অ্যামিনো গ্রুপকে গ্লুটামেট থেকে অন্য আলফা-কিটো অ্যাসিডে নিয়ে যাওয়ার জন্য এক ধরনের এনজাইম ট্রান্সমিনেস ব্যবহার করে। উদাহরণস্বরূপ, অ্যাসপার্টেট অ্যামিনোট্রান্সফারেজ এনজাইমটি গ্লুটামেট এবং অক্সালোঅ্যাসিটেটকে, আলফা-কিটোগ্লুটারেট এবং অ্যাসপার্টেটে রূপান্তর করে। [১১২] অন্যান্য প্রাণীসত্তাগুলিও ( organisms) অ্যামিনো অ্যাসিড সংশ্লেষণের জন্য ট্রান্সমিনেস এনজাইমগুলি ব্যবহার করে।
অনাদর্শ অ্যামিনো অ্যাসিডগুলি সাধারণত আদর্শ অ্যামিনো অ্যাসিডগুলির সামান্য পরিবর্তনের মাধ্যমে গঠিত হয়। উদাহরণস্বরূপ, হোমোসিস্টাইন গঠিত হয় ট্রান্সসালফিউরেশন নামক বিপাকীয় পথের মাধ্যমে বা মধ্যবর্তী বিপাক এস -অ্যাডিনোসিলমেথিওনিনের মধ্য দিয়ে মেথিওনিনের ডিমিথিলেশনের মাধ্যমে,[১১৩] আর, হাইড্রোক্সিপ্রোলিন তৈরি হয় প্রোলিনের ট্রান্সলেশন পরবর্তী সামান্য পরিবর্তনের মাধ্যমে। [১১৪]
অণুজীব এবং উদ্ভিদ সমূহ অনেক অসাধারণ অ্যামিনো অ্যাসিড সংশ্লেষণ করে। উদাহরণস্বরূপ, কিছু জীবাণু 2-অ্যামিনোআইসোবিউটাইরিক অ্যাসিড এবং ল্যানথিওনিন তৈরি করে, যা অ্যালানিনের একটি সালফাইড-সংযুক্ত ডেরিভেটিভ (অ্যালানিন জাত যৌগ)। এই দু প্রকার অ্যামিনো অ্যাসিডই পেপটাইডীয় ল্যান্টিবায়োটিক (peptidic lantibiotics) যেমন অ্যালামেথিসিনে পাওয়া যায়। [১১৫] যাইহোক, উদ্ভিদের মধ্যে, 1-অ্যামিনোসাইক্লোপ্রোপেন-1-কারবক্সিলিক অ্যাসিড হল একটি ছোট দ্বি-প্রতিস্থাপিত চাক্রিক অ্যামিনো অ্যাসিড যা উদ্ভিদের হরমোন ইথিলিন উৎপাদনের ক্ষেত্রে একটি মধ্যবর্তী যৌগ হিসেবে কাজ করে। [১১৬]
Remove ads
বিক্রিয়া সমূহ
সারাংশ
প্রসঙ্গ
অ্যামিনো অ্যাসিডগুলি সেইসব বিক্রিয়াই দেয় যেগুলি তাদের উপাদানগত কার্যকরীমূলক সমূহ বিবেচিনায় প্রত্যাশিত। [১১৭][১১৮]
পেপটাইড বন্ধন গঠন

যেহেতু, অ্যামিনো অ্যাসিডের অ্যামাইন এবং কার্বক্সিলিক অ্যাসিড উভয় গ্রুপই অ্যামাইড বন্ধন তৈরির জন্য বিক্রিয়া করতে পারে, তাই একটি অ্যামিনো অ্যাসিড অণু অন্যটির সাথে বিক্রিয়া করতে পারে এবং অ্যামাইড সংযোগের মাধ্যমে পরস্পর যুক্ত হতে পারে। অ্যামিনো অ্যাসিডের এই পলিমারাইজেশন-ই হলো সেই প্রক্রিয়া যা প্রোটিন তৈরি করে। এই ঘনীভবন বিক্রিয়া নবগঠিত পেপটাইড বন্ধনের সাথে সাথে পানির একটি অণু উৎপন্ন করে। কোষে, এই বিক্রিয়া সরাসরি ঘটে না; এর পরিবর্তে, অ্যামিনো অ্যাসিড প্রথমে একটি এস্টার বন্ডের দ্বারা একটি স্থানান্তর আরএনএ অণুর সাথে সংযুক্তির মাধ্যমে সক্রিয় হয়। অ্যামিনোঅ্যাসাইল টিআরএনএ সিন্থেটেজ কর্তৃক ATP- নির্ভর বিক্রিয়া দ্বারা এই অ্যামিনোঅ্যাসাইল-টিআরএনএ ( aminoacyl-tRNA) উৎপন্ন হয়।[১১৯] এই অ্যামিনোঅ্যাসাইল-টিআরএনএ তখন রাইবোসোমের জন্য একটি সাবস্ট্রেট হিসেবে কাজ করে, যা এস্টার বন্ডে দীর্ঘায়িত প্রোটিন চেইনের অ্যামিনো গ্রুপের আক্রমণের ক্ষেত্রে অনুঘটক হিসেবে কাজ করে। [১২০] বিক্রিয়ার এই কলা-কৌশলের ফল এই যে, রাইবোসোম দ্বারা তৈরি সমস্ত প্রোটিন সংশ্লেষিত হয় তাদের এন -প্রান্তসমূহ (N-terminus) থেকে শুরু করে এবং অগ্রসর হতে থাকে তাদের সি -প্রান্তসমূহের (C-terminus) দিকে।
যাইহোক, সকল পেপটাইড বন্ধন এই পদ্ধতিতে গঠিত হয় না। কোন কোন ক্ষেত্রে, পেপটাইডগুলি নির্দিষ্ট কিছু এনজাইম দ্বারা সংশ্লেষিত হয়। উদাহরণস্বরূপ, ট্রাইপেপটাইড গ্লুটাথিয়ন হলো জারণগত পীড়নের ( oxidative stress) বিরুদ্ধে কোষের প্রতিরক্ষার একটি অপরিহার্য অংশ। এই পেপটাইড মুক্ত অ্যামিনো অ্যাসিড থেকে দুই ধাপে সংশ্লেষিত হয়। [১২১] প্রথম ধাপে, গ্লুটামেটের পার্শ্ব-শিকল কার্বক্সিল (এই পার্শ্ব-শিকলের গামা কার্বন) এবং সিস্টাইনের অ্যামিনো গ্রুপের মধ্যে গঠিত পেপটাইড বন্ধনের মাধ্যমে গামা-গ্লুটামিলসিস্টাইন সিন্থেটেস এনজাইমটি সিস্টাইন এবং গ্লুটামিক অ্যাসিডকে ঘনীভূত করে। এই দ্বি-পেপটাইড (যৌগটি) তারপর গ্লুটাথিয়ন সিন্থেটেজ দ্বারা গ্লাইসিনের সাথে ঘনীভূত হয়ে গ্লুটাথিয়ন তৈরি করে। [১২২]
রসায়নে, পেপটাইডগুলি বিভিন্ন প্রকার বিক্রিয়া দ্বারা সংশ্লেষিত হয়। এরমধ্যে কঠিন-দশা পেপটাইড সংশ্লেষণে সর্বাধিক ব্যবহৃত বিক্রিয়াটিতে অ্যামিনো অ্যাসিডের অ্যারোমেটিক অক্সাইম-জাত যৌগগুলিকে সক্রিয়িত একক হিসাবে ব্যবহার করা হয়। এগুলিকে ক্রমবর্ধমান পেপটাইড শিকলে ক্রমানুসারে যোগ করা হয়, যা একটি কঠিন রেজিন (resin) অবলম্বনের সাথে সংযুক্ত থাকে। [১২৩] পেপটাইড লাইব্রেরিগুলি উচ্চ-থ্রুপুট স্ক্রীনিং প্রক্রিয়ার মাধ্যমে ঔষধ আবিষ্কারে ব্যবহৃত হয়। [১২৪]
কার্যকরী মূলকসমূহের সংমিশ্রণ অ্যামিনো অ্যাসিড গুলিকে ধাতু-অ্যামিনো অ্যাসিড চিলেট যৌগ গঠনের ক্ষেত্রে কার্যকর বহু -দাঁত-যুক্ত (polydentate ) লিগ্যান্ড হতে সহায়তা করে। [১২৫] অ্যামিনো অ্যাসিডের একাধিক পার্শ্ব-শিকলও রাসায়নিক বিক্রিয়ায় অংশ গ্রহণ করতে পারে।
ক্যাটাবলিজম

* গ্লুকোজেনিক- এদের রাখা হয় গ্লুকোজেনেসিস দ্বারা গ্লুকোজ গঠনের ক্ষমতাসম্পন্ন উৎপাদগুলির সাথে
* কেটোজেনিক- এদের রাখা হয় এমন সব উৎপাদগুলির সাথে যাদের গ্লুকোজ গঠনের ক্ষমতা নেই। এই উৎপাদগুলি এরপরও কেটোজেনেসিস বা লিপিড সংশ্লেষণের জন্য ব্যবহৃত হতে পারে।
* অ্যামিনো অ্যাসিডগুলি গ্লুকোজেনিক এবং কিটোজেনিক উভয় ধরনের উৎপাদেই বিপাকিত ( catabolized) হয়।
অ্যামিনো অ্যাসিডের ক্ষয় প্রক্রিয়ায় (Degradation) প্রায়শই অ্যামোনিয়াহীনকরণ জড়িত যখন এটি আলফা-কিটোগ্লুটারেট হিসেবে অ্যামিনো গ্রুপকে সরিয়ে গ্লুটামেট গঠন করে। এই প্রক্রিয়ায় ট্রান্স অ্যামিনেসিস জড়িত, যা প্রায়শই সংশ্লেষণের সময় অ্যামোনিয়াকরণে (অ্যামিনেশন) ব্যবহৃত প্রক্রিয়াগুলির অনুরুপ। অনেক মেরুদণ্ডী প্রাণীতে, অ্যামিনো গ্রুপটি ইউরিয়া চক্রের মাধ্যমে পরবর্তীতে সরানো হয় এবং ইউরিয়া আকারে মূত্রের মাধ্যমে বের হয়ে যায়। যাইহোক, অ্যামিনো অ্যাসিডের ক্ষয়করণ এসবের পরিবর্তে ইউরিক অ্যাসিড বা অ্যামোনিয়া তৈরি করতে পারে। উদাহরণস্বরূপ, সেরিন ডিহাইড্রেটেস এনজাইমটি সেরিন যৌগকে পাইরুভেট এবং অ্যামোনিয়াতে রূপান্তরিত করে। [৮৬] এক বা একাধিক অ্যামিনো গ্রুপ অপসারণের পরে, অণুর অবশিষ্টাংশ কখনও কখনও নতুন অ্যামিনো অ্যাসিড সংশ্লেষণে ব্যবহৃত হতে পারে, অথবা এটি ব্যবহৃত হতে পারে শক্তির উৎস হিসেবে যেক্ষেত্রে এটি গ্লাইকোলাইসিস বা সাইট্রিক অ্যাসিড চক্রে প্রবেশ করে যেমনটি ডানদিকে চিত্রে বিস্তারিত দেখানো হয়েছে।
জটিল যৌগ গঠন
অ্যামিনো অ্যাসিড সমূহ হল দ্বি-দন্ত (bidentate) লিগ্যান্ড, যারা অবস্থান্তর ধাতু অ্যামিনো অ্যাসিড কমপ্লেক্স গঠন করে। [১২৭]
Remove ads
রাসায়নিক বিশ্লেষণ
জৈব পদার্থে নাইট্রোজেনের মোট পরিমাণ (total nitrogen content) প্রধানত প্রোটিনের অ্যামিনো গ্রুপ দ্বারা গঠিত হয়। মোট জেলদাল নাইট্রোজেন (Total Kjeldahl Nitrogen- TKN) হল নাইট্রোজেনের একটি (পরিমাণগত) পরিমাপ যা ব্যাপকভাবে (বর্জ্য) পানি, মাটি, খাদ্য, পশুখাদ্য (ফিড) এবং সাধারণভাবে জৈব পদার্থের বিশ্লেষণে ব্যবহৃত হয়। নাম অনুসারে, জেলদাল পদ্ধতি (Kjeldahl method ) প্রয়োগ করা হয়। অধিকতর সংবেদনশীল পদ্ধতিগুলো সুপ্রচুর। [১২৮][১২৯]
Remove ads
আরও দেখুন
তথ্যসূত্র
অতিরিক্ত পঠন
বহিঃসংযোগ
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads