Лаймската болест (Morbus laimi, Лаймска борелиоза, борелиозис бургдорфери или само борелиоза) е инфекциозно заболяване, причинявано от поне четири различни вида бактерии представители на рода Борелия.[1][2] Борелия бургдорфери[3] е основният причинител на болестта в Северна Америка, докато Борелия афзелии, Борелия гаринии, Borrelia spielmanii и др. причиняват повечето случаи в Европа и Азия[4]. Въпреки сравнително бавната им скорост на делене бактериите от род Borrelia успешно мутират и напоследък се откриват нови видове, както и различни щамове на вече известните. Напоследък се докладват случаи от Австралия и Африка[5].
Тази статия се нуждае от подобрение. Необходимо е: форматиране. Ако желаете да помогнете на Уикипедия, използвайте опцията редактиране в горното меню над статията, за да нанесете нужните корекции. |
| Лаймска болест | |
 | |
| Класификация и външни ресурси | |
|---|---|
| МКБ-11 | 1C1G |
| МКБ-10 | A69.20 |
| База данни MedlinePlus | 001319 |
| База данни eMedicine | article/330178 article/965922 article/786767 |
| Мед. рубрики MeSH | D008193 |
| Лаймска болест в Общомедия | |
Борелиите са уникални с т.нар. ендофлагела и начина на движение. Ендофлагелата е разположена в периплазменото пространство между полутвърда пептидогликанова основа и многослойна подвижна външномембранна обвивка. Когато филаментите се съкращават борелията се движи с въртеливи, подобни на отварачка, движения. Широко разпространени са във вискозна среда – водни седименти, биофилми, мукозни тъкани, серум и чревен тракт на хора. Начинът им на движение е адаптация към характеристиките на средата. Локализирането на флагелата, която нормално е основен бактериален антиген, във вътрешността на клетката им позволява да я скрият от имунната система на гостоприемника. Възможностите им за рекомбинантност на външния протеин VlsE е един от механизмите за реинфекция и избягване на имунния отговор[6][7][8].
Борелиите са едни от малкото патогенни бактерии, които могат да живеят без желязо. В ензими, участващи в жизнените процеси на микроорганизма желязо‐сулфидните съединения са заменени с манган[9][10][11][12][13][14]. Така избягват проблема на останалите патогенни бактерии да се борят с клетките на хазяина за достъп до железни йони. Третият по ред организъм на земята с напълно секвениран геном (1997 г.) след H.influenzae и M.genitalium през 1995 г. Геномът съдържа 910 725 базови двойки и 853 гена. Борелиите имат бавна скорост на делене и това е един от методите им за избягване на имуния отговор на гостоприемника[15].
Заболяването е наречено на градовете Лайм и Олд Лайм в Кънетикът, САЩ, където е диагностицирано за пръв път през 1975 г. като отделно и специфично състояние.
Лаймската болест е най-честото заболяване предавано от кърлежи в северното полукълбо.[16] Borrelia се разпространява у хората след ухапване от твърдите еленови кърлежи.[17] Съобщавани са случаи, при това потвърдени серологично, на пренасяне на лаймска болест чрез бълхи, някои видове мухи и комари. Ранните симптоми включват висока температура и втрисане, главоболие, прострация, депресия и доста често – характерен патогномостичен симптом наречен еритема мигранс (на латински: Erythema chronicum migrans)[18][19]. Оставена без лечение, признаците на болестта прогресират като се проявяват в ставите, сърцето, лимфната система и централната нервна система. В повече от случаите (около 80%) симптомите изчезват при адекватно антибиотично лечение, стига да се постави навременна и правилна диагноза.[20] Забавено, недостатъчно като продължителност или неадекватно лечение може да доведе до сериозни и трудно лечими или нелечими последствия.[21] Благодарение на различните форми на бактерията (спирохетна, L-форма[22], циста[23] и обвити в биофилм колонии)[24][25][26][27][28][29][30] в много случаи е наблюдавана резистентност към различни антибиотици, включително и към обичайно прилаганите в съвременната медицина [31][27][32][33][34][35][36] [29][37]. Това би обяснило и колебанието и несигурността на серологичните тестове, които се основават на антитела отговарящи на клетъчната стена на бактерията [22]. Най-нови изследвания показват, че този плеоморфизъм на бактерията изисква и различно медикаментозно третиране. Докладвани са случаи на подобрение на симптоматиката след повторно антибиотично третиране.
Новите изследвания сочат по-висока честота на заразеност на кърлежите с участващите в коинфекциии бактерии. В случаите на коинфекция се изисква комплексна терапия. В популярни информационни блогове се посочва, че около 10% от кърлежите в България са носители на борелии[38]. Това е манипулация на общественото мнение, тъй като подобна статистика е невъзможно да се направи и тя не стои на научни методи – в страната няма лаборатория, която да прилага културиране на бактерията и не може да се отчете процентът (а той е висок) на грешката от фалшиво негативните PCR анализи на кърлежите.
Приеманият за психичен синдром и несъществуваща фантазия (Delusional parasitosis) Моргелонов синдром (Morgellons disease или Morgellons syndrome) в много случаи е причиняван от бактериите на Borrelia burgdorferi [39][40].
Исторически сведения за заболяването
Първите сведения за заболяването датират от месец ноември 1975 г., когато две деца от Олд Лайм заболяват. Първите проучвания на естеството на болестта са проведени в края на 1970-те, но бактериалният произход на болестта е доказан едва през 1981 година, когато Борелия бургдорфери (B. burgdorferi) е идентифицирана от Уили Бъргдорфър, който изолира причинителя от кърлежа Dermacentor variabilis. Преди това обаче е разкрита връзката на заболяването с ухапването от кърлеж. Това става от А. Спилмън (A. Spielman) през 1977 г., който доказва преносителството от кърлежа Иксодес дамини (Ixodes dammini)[41].
Съществуват писмени сведения, които показват, че признаците на заболяването са известни още преди столетие. Така например през 1883 г. и 1902 г. е описан acrodermatitis chronica atropicans [42], една от формите на лаймската болест. През 1909 г. пред Дружеството на дерматолозите в Стокхолм е докладван случай на пациент със специфично заболяване след ухапване от кърлеж, което е наречено erythema chronicum migrans[41]. През 1922 г. във Франция и 1941 г. в Германия са описани различни поражения на нервната система след ухапване от кърлеж. По-рядко срещаният синдром лимфаденоза е описан през 1943 г[43].
Първият случай на лаймска болест в България е открит и описан през 1987 г., доказан серологично в Швейцария[43].
Разпространение

Борелиозата е разпространена в североизточната умерено-континентална част на САЩ[44] и в райони на Централна Азия, Южна, Централна и предимно Северна Европа. От началото на епидемиологично наблюдение в САЩ, само в щата Ню Йорк са регистрирани над 95 000 случаи на болестта[45]
Заболеваемостта в Европа е между 0,3 и 130 на 100 000[19]. Поради непоносимостта към по-топъл климат, най-засегнати в Европа са скандинавските държави и централните планински части на континента. Болестта се среща и в България. Българските епидемиологични служби докладват около 600 – 800 случая годишно (10 – 12 на 100 000)[19], най-често при деца и възрастни между 45 – 65 години[19]. През 1990-те години ежегодно са регистрирани средно по около 300 случая, като в последните години броят значително се увеличава. Наблюденията показват, че съществуват природни огнища в Бургаска, Варненска, Шуменска, Великотърновска, Видинска и други области[43].
Етиология
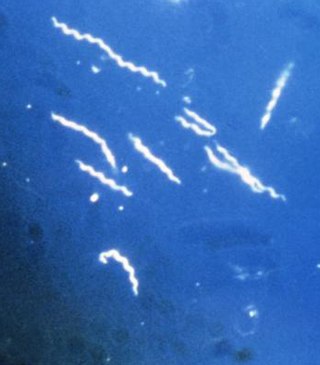
Епидемиология

Източници на зараза
Болестта е типичен пример за зооноза. В природата за резервоар на инфекцията служат различни диви и понякога домашни животни, включително и някои гнездящи на земята птици (общо около 300 вида)[46]. Бактерии са намирани в горски и полски гризачи, елени, коне, кучета и други. Благоприятни региони за резервоарните гостоприемници и векторите на болестта са гористи и влажни местности, не по-високи от 2000 метра[19] над морското равнище. Твърдотелите кърлежи от род Ixodes са вектори на лаймската болест, бартенолозата (фелиноза), бабезиозата, кърлежовия енцефалит и кримската треска. Те се заразяват с бактериите и вирусите при паразитиране върху резервоарен гостоприемник (заразено животно) и чрез ухапване предават инфекцията на други животни и в частност на човека. Заразените кърлежи са в състояние да предават борелиозата на собственото си потомство, образувайки природни огнища.
В САЩ основен резервоар е белоногата мишка (Peromyscus leucopus). При 75% от представителите на този вид са открити антитела срещу борелията. Други резервоари на инфекцията са белоопашатия елен (Odocoileus virginianus), северноамериканската (Tamias striatus) и червената катерица (Tamiasciurus hudsonicus). В Европа основен резервоар са гризачите от род Apodemus – полска и обикновена горска мишка. Важно значение като резервоар на заразата имат прелетните птици, които освен като донори на кръв за кърлежите, могат да пренесат инфекцията на големи разстояния като така разширяват ареала на разпространение на болестта и създават нови природни огнища[47].
Ухапването от кърлежи е най-често през летните месеци, като нимфите са най-активни от средата на май до средата на август, а възрастните кърлежи от август до ноември[45]. Kърлежите са активни и хапят при наднулеви температури.[45] Доказано е трансовариално (т.е. през яйцето) предаване на причинителите на лаймската болест при кърлежите[48]. При борелиозата, както и при други инфекциозни болести е важно да се предадат определен прагов брой бактерии (според компетентността на имунната система). Добре функционираща имунна система може да преодолее агресията, но спирохетата ще остане в организма. Остарели и неправилни са схващанията[45][49], че за предаването на борелийните спирохети обикновено са необходими 24 до 48 часа контакт на кърлежа с човека, преди трансмисия на бактериите[50]. Кратък контакт не означава, че причинителите няма да могат да преминат в кръвообращението на човека[50].
Механизъм и фактори на предаване
Лаймската болест изисква членестоног вектор (кърлеж, бълха); в старата литература често се посочва, че тя не е заразно (контактно-инфекциозно) заболяване и не се предава от човек на човек [49]. В противоречие с това са описани случаи на предаване чрез майчино мляко и сълзи. Днес авторитетни микробиологични и клинични статистически изследвания се доказва, че бактериите се съдържат и в човешките секрети[51] и предаването по полов път също е възможно[52]. Била е приемана за психичен синдром и заклеймявана от Центъра за контрол и превенция на заболяванията на САЩ(CDC) несъществуваща фантазия (Delusional parasitosis), днес е доказано наличие на борелиоза при случаи на моргелоновата болест[39] (Morgellons disease или Morgellons syndrome).
Механизмът на предаване на заразата при това заболяване е трансмисивен, с преносители кърлежи от род Ixodes. Заразяването на човека става основно от ухапване на инфектирани кърлежи. В САЩ заразяване става основно с кърлежите Иксодес скапуларис (Ixodes scapularis) и Иксодес пацификус (Ixodes pacificus). Кърлежът Иксодес дамини (Ixodes dammini) е заразен с борелията до 100%[48]. В Европа това е кърлежът Иксодес рицинус (Ixodes ricinus), а в Азия е Иксодес персулкатус (Ixodes persulcatus)[48].
Не при всички случаи е доказано ухапване от кърлеж. Така например е установено, че борелията се отделя чрез урината на белоногата мишка. В САЩ е доказана ролята на предаване от комари от род Aedes, папатациеви мушици, оборни мухи (Stomoxys calcitrans, Tabanus sudeticus). Доказано е и преминаване на причинителя през плацентарната бариера, което прави възможно и утеринното заразяване. По-рядко е възможно причинителят да попадне през конюнктивата след размачкване на заразен кърлеж[48].
Отстраняване на впит кърлеж
Тъй като само по себе си ухапването е безболезнено и не предизвиква силните сърбежи свързани с ужилвания на комари или болките от ужилване от пчели или оси, важно е при пътувания в местности с ендемично присъствие на кърлежи, в края на деня да се направи пълна инспекция на потенциално откритите (а по възможност на всички) части на тялото и ако се забележи кърлеж, много внимателно да се отстрани. Опитните туристи или хората живеещи в потенциални ендемични райони на болестта имат винаги пинцета, за бавно и предпазливо изтръгване на паразита. Инструкциите за измъкване са следните:
- Използвайте пинцета с фини челюсти и внимателно защипете паразита колкото се може по-близо до кожата си.
- С постоянно налягане, без треперене, изтеглете кърлежа, перпендикулярно на плоскостта на кожата.
- В случай, че смукалцето се откъсне и остане впито, опитайте се да го защипете и измъкнете, но без да създавате допълнителна кожна травма.
- Ако не успеете, оставете го и кожата ще се заздрави от само себе си[53].
- С алкохол, йодна тинктура, и антибиотична паста (не е наблюдавано заразяване след намазване с азитромицинова паста), почистете мястото и ръцете си.
- Не се препоръчват псевдомедицински „народни“ лечения. Ако сте близо до медицински пункт или заведение, потърсете компетентна помощ.
- Не забавяйте интервенцията: ако медицинската помощ е на повече от няколко часа път, си окажете сами първа помощ.
- Времето HE E ваш съюзник. Целта е да не се допусне прехвърляне на голям брой спирохети по кръвен път.
Като цяло по-голямата част от ухапванията не причиняват заболяване[19]. Проблемът обаче е, че много заразени лица остават носители на бактерията и тя пребивава в латентна форма до подходящ момент на отслабена имунна система[54].
Възприемчивост и имунитет
Възприемчивостта на хората към лаймска болест е всеобща. Имунитетът е несигурен и краткотраен[48].
Патогенеза
Входната врата на борелията е кожата, ухапана от кърлеж. На входното място възниква възпалителен процес, който се разпространява в съседните участъци. След попадането в кръвния и лимфния поток причинителите на заболяването се локализират в черен дроб, далак, лимфни възли, органи от сърдечно-съдовата система, стави, нервна система, очи. Засягането на различните органи и системи е последователно, с продължителни промеждутъци от време продължаващи месеци и дори години. Общотоксичните признаци са причинени от ендотоксемията[55].
Стадийното протичане и склонността към хронифициране се дължат на развитието на инфекциозно-алергични процеси при неадекватен клетъчен и хуморален имунитет. Образуваните в началото антитела са само срещу някои антигени на причинителя, което става причина за временното потискане на размножаването му. Това обяснява появата на спирохетемии и рецидивиращото протичане на болестта. След всеки нов пристъп титърът на антитела нараства. Към края на първия месец се увеличават антителата от клас IgM, а по-късно и тези от клас IgG и едва когато нараснат в достатъчно количество, настъпва самоизлекуване[55].
Клинични признаци



Инкубационният, ранен-локализиран период на болестта (от първия конакт с причинителя до появата на първите симптоми) варира от 3 до 30 дни, но най-често е от 7 до 14 дни[49]. Някои хора получават на мястото ухапано от кърлежа малка локално зачервена подутина (като след ухапване от комар), която изчезва след 1 – 2 дни. Това само по себе си не е доказателство за заразяване с болестта. Подутината е признак, че организмът е отчел присъствие на външни патогени, но не задължително и изключително на борелия бургдорфери; има различни видове други паразитни организми, но вероятно по-малко опасни, които могат да се предадат с ухапването. Лаймската борелиоза, като полисистемно заболяване е заменила сифилиса в ролята му на „хамелеон“ сред инфекциозните болести.
Първа фаза на болестта
Без лечение лаймската болест протича в три фази с периоди на затихвания, изостряния и различни клинични прояви във всеки един от тях. Преминаването от една фаза в друга обикновено е плавно, но понякога има симптоми, характерни за няколко фази едновременно[19]. Първата фаза, развиваща се непосредствено след ухапването, може да протече без оплаквания и да остане незабелязана. При 70 – 80% от инфектираните лица, около мястото на ухапване от кърлежа се наблюдава зачервяване с характерната мишенообразна форма и се нарича мигриращ еритем (на латински: erythema migrans). Проявяването на мигриращия обрив може да се забави от 3 до 30 дни[56]. Първоначално размерът е около 5 см като нараства и се разширява откъм периферията и избледнява централно, а в рамките на следващите няколко дни може да достигне до 30 см[56]. Мигриращият еритем може да се наблюдава на различни части на тялото. Възможно е да се очертаят два пръстена – т.нар. „пръстен в пръстена“ или още „биволско око“. При докосване обривът е топъл и се задържа 3 – 5[57] седмици, като може да рецидивира. През първата фаза на инфекцията, болните се оплакват от грипоподобни симптоми: като общо неразположение, бърза умора, повишена температура с втрисане, фотофобия – чувствителност към светлина и др.
Втора фаза на болестта
Втората фаза – на ранна генерализация на инфекцията, обхваща период от няколко седмици до няколко месеца след ухапването. По това време може да се наблюдават палпитации, нови места с мишенообразен обрив,силна замаяност или световъртеж,шум в ушите,силни главоболия, подувания, мускулни и ставни болки, и проблеми с безсъние. Много от тези оплаквания може да утихнат и без лечение[58]. Неврологичните оплаквания се наблюдават при 15 – 20% от нелекуваните пациенти като при над 10% от болните симптомите могат да останат хронични[56]. Измежду по-сериозните симптоми се числи парезата на лицевия нерв (CN VII), (на латински: Nervus facialis) или други черепно-мозъчни нерви[56]. Наблюдава се предимно едностранна (по-рядко двустранна) парализа на лицевия нерв. Главоболието се обяснява с раздразненост на менингите, също може да се наблюдава вратна ригидност, фотофобия – чувствителност към светлина, радикулоневрит, стрелкащи болки, често по време на сън. Ликворът е с леко завишено белтъчно съдържимо и лимфоцити или без изменения. С тези неврологични промени болестта протича синдромно, известна като „кърлежов менингорадикулоневрит“ и може да се прояви в разгърнат вид или само като част от отделните си компоненти[19][56]. При около 10%[19] от болните във втората фаза на болестта се развива променлив атриовентрикуларен блок, рядко лявокамерна недостатъчност или кардиомегалия. При последните може да се наблюдават аритмии, „прескачане на съцето“, прималяване и задух. Продължителността на сърдечните симптоми е от няколко дни до няколко седмици, като понякога рецидивират[19]. Инфекзиозен артрит се наблюдава в около 60%[56] от случаите, главно при случаите на заразяване с B. burgdorferi sensu stricto. Оплакванията са остра болка и подуване, зачервяване най-често на една става (коляното или китката) и трябва да се разграничи от другите артралгии, които имат подобни симптоми[56]. При някои от заразените се наблюдава по-силно или по-слабо изразена лимфаденопатия, очни промени, изразяващи се в конюнктивит,ако инфекцията е достигнала до мозъка е възможно да причини синдром на визуален сняг,който включва много на брой странни визуални възприятия,при който мозъка предава грешни сигнали към очите.Болки в очите.Много по-рядко в панофталмит, последван от слепота[19]. Около 20% от болните развиват трансаминит (субклинични чернодробни симптоми). При видовете B. garinii, spielmanii и afzelii оплакванията най-често са неврологични, съпроводени с трудни за лечение хронични кожни изменения – acrodermatitis chronica atrophicans [42]. В хода на заболяването може да се засегнат и други органи и системи.
Трета фаза на болестта
Третата фаза на късна персистираща симптоматика обхваща от няколко месеца до няколко години след ухапването. Според Центъра за контрол и превенция на заболяванията на САЩ (CDC), причините за симптомите по време на тази късна фаза не са напълно изяснени. Въпреки множеството изследвания, които доказват противното, CDC отрича възможността да продължава инфекция с Борелия бургдорфери (на латински: B. burgdorferi). Противоположно становище изразява Международното общество за лаймска болест (International Lyme And Associated Diseases Society). Редица експерименти върху мишки, кучета и маймуни показват, че дори след агресивно антибиотично третиране бактериите могат да бъдат изолирани от животните чрез ксенодиагностика или ДНК (PCR) тест [59]. В САЩ борбата с лаймска е станала и част от политиката – Центъра за контрол и превенция на заболяванията на САЩ (CDC) отхвърля „хроничността“ на заболяването, тъй като в противен случай здравноосигурителните фондове ще трябва да покриват разноските[60]. Infectious Diseases Society of America (IDSA) признава опасността от перзистираща борелиоза[61]. Приеманият за психичен синдром и заклеймяван от Центъра за контрол и превенция на заболяванията на САЩ(CDC) като несъществуваща фантазия (Delusional parasitosis) Моргелонов синдром (Morgellons disease или Morgellons syndrome) в много случаи е причиняван от бактериите на Borrelia burgdorferi[39].
Тази фаза на персистираща симптоматика се наблюдава в около 10 – 20%[56] от хората след начално фазово антибиотично лечение.
Оплакванията са най-често:
- мускулни и ставни болки (миалгии и артралгии),
- проблеми с безсъние, умора,
- отслабване на паметта и концентрацията и
- деменция (оглупяване). [56]
Развива се прогресиращ енцефаломиелит, с общомозъчни симптоми и засягане на периферните нерви, с прояви на:
- лесна уморяемост,
- влошена координация,
- отслабване до загуба на чувствителността на крайниците,
- тръпнене и бодежи в ръцете и краката,
- слабост в мускулите.
Опорно-двигателен апарат:
- наблюдава се трайно засягане на ставите: подуването, болката и ограничените движения в една или няколко стави стават постоянни.
- най-често това са коленните и други големи стави. [19].
Сърдечно-съдови симптоми:
- Нерядко има симптоми, произтичащи от трайни увреждания на сърдечносъдовата система.
Кожни симптоми и оплаквания:
- хроничният атрофиращ акродерматит е кожна проява на лаймската болест, откривана често години след мигриращия еритем. Той започва със зачервени, окръглени петна по кожата, които впоследствие склерозират и атрофират. [19]
Тези оплаквания се класифицират като „посттерапевтичен синдром на лаймска болест“ (ПТСЛБ). Някои изследвания показват, че продължаване на антибиотична терапия не се препоръчва. Други изследвания опровергават тази теория и определят тази фаза като хронична борелиоза (хронична лаймска болест)[62] и подкрепят нуждата от продължителни антибиотични курсове. Съществува теория, че става дума за автоимунна реакция, при която в отсъствие на причинителя имунната система реагира агресивно, нанасяйки вреда върху тялото. [56] В тази фаза антибиотик не се препоръчва от CDC; лица с ПТСЛБ третирани с антибиотици могат да пострадат от ненужни усложнения. [56] Последни изследвания доказват, че става дума за перзистиращи форми на Borrelia, както и цистни форми и обвити с биофилм колонии, като се изследват нови форми за лечение чрез одобрени от американската FDA (Food and Drug Administration) антибиотични средства[62][63][29][37]. Тези форми, лишени от клетъчна мембрана или с променена такава, не могат да бъдат регистрирани от повечето лабораторни тестове, тъй като те се основават на зависещите от наличие на клетъчна мембрана антитела.
Накрая заболяването завършва с наличието на трайна мускулна дистрофия, деформации и анкилози на засегнатите стави. Крайната еволюция на кожните промени е acrodermatitis chronica artophicans [42] или sclerodermia guttata[64].
По отношение на клинико-епидемиологичен аспект са известни две основни форми на лаймската болест – американска и европейска. За американската форма са характерни по-лекото начало, по-оскъдните кожни изменения, по-честото или по-тежко засягане на ставния апарат. При европейската форма началото е по-остро, кожните изменения са по-чести, а неврологичната находка е по-богата [64].
Диагноза
Диагнозата на лаймската болест без история на заболяването може да е комплексна и трудна. В България липсват изследвания, както и адекватни тестове за установяване на редица векторнопреносими коинфекции. Описани са смъртни случаи при първоначално негативни серологични тестове и доказани постмортем. Опитен диагностик ще снеме добра анамнеза преди пристъпване към анализ на общи инфекциозни или артритни болки. Задължителен въпрос е „Пътували ли сте и къде, в последните 10 – 30 дни?“ Индексът на подозрение се качва многократно, ако отговорите на въпросите ви поставят в район с известно епидемиологично огнище. Това, и патогномостичният симптом еритема мигранс, опростяват по-нататъшните диференциални диагнози. Без тези първи стъпки, разнообразното засягане на различни органи и системи през различните стадии гарантират възможно погрешна диагноза поради противоречиво интерпретиране на клиничната картина и резултати от лабораторните изследвания. [65] С правилна анамнестична насока и при наличие на модерно медицинско обслужване е нужно да се направят серологични тестове, които трябва да се осъществят не по-рано от един месец след ухапването от кърлеж и чрез които се търси доказването на различни класове антитела срещу причинителя. [65] Разработен е и метод за ранно диагностициране на базата на метаболитни биосигнатури [66][67]. Проби за наличие на ДНК на бактериите (PCR) обаче могат да се вземат още непосредствено при появата на еритема мигранс. ДНК тестът е високо-показателен по отношение на тъканни проби, но недостоверен по отношение на кръв или ликвор. Липсва стандартизация между тестовете предлагани от различните лаборатории. Съществуващите тестове може да се отличават с висока специфичност, но с ниска сензитивност – често резултатът е фалшиво негативен [31]. В диагностиката на лаймската болест се прилага и тест за лимфоцитна трансформация (Lymphocyte Transformation Test), който е показателен и за успеха на лечението. [68][69][70]. Макар и признат от редица страни и лаборатории този тест в България не се използва. Тълкуването на резултатите трябва да става в контекста на цялостната клинична картина и е работа на квалифициран лекар инфекционист. [19] В американската медицинска практика CDC препоръчва двуетапна лаборатория, която да протече симултанно, за да се намалят фалшиво-позитивните резултати и ненужно потенциално-токсично антибиотично лечение на погрешна етиология; едновременно с това, при наличие на оправдани съмнения в инфекциозния характер на заболяването, може да се използва само първият тест, с надеждата той да даде категорично отрицателен или положителен, а не неопределен резултат.[71] Първият етап на лабораторните тестове е ензимно имуноесе (на английски: enzyme immunoassay)[72] или също, но по-рядко, непряко имунофлуоресцентно есе (на английски: indirect immunofluorescence assay). [71] Вторият етап на лабораторията е имуноблотен тест (на английски: immunoblot test, Western blot). Положителен резултат е само двойно-положителният, т.е. и от двата анализа. Не се препоръчва изпускането на едно от двете диагностични направления, поради вероятна неправилна диагноза и съответно лечение. Въпреки това не бива да се изключва възможността за отрициателни серологични тестове въпреки наличие на борелиоза. Не трябва да се забравя, че сигурността на изредените диагностични тестове не е пълна и лечението в някои случаи се препоръчва да е въз основа на симптоматиката [6][22].
Диференциална диагноза
Без обстойна лаборатория, диференциалната диагноза на заболяването е обширна, тъй като лаймската болест може да наподоби редица заболявания на кожата, нервната система, опорно-двигателния апарат и сърцето. [19]
Лечение
При борелиоза се препоръчва лечение за намаляване на продължителността на заболяването и предотвратяване на евентуална прогресия. Спирохетите Борелия бургдорфери са чувствителни към някои антибактериални препарати. Средство на избор са полусинтетичните пеницилини, цефалоспорините, макролидите, някои флоуроквинолони[73] и пр. [19][74]. Българските методи на лечение се различават дори и от одобрените американски указания и клинични пътеки предимно по по-късата продължителност на лечението, но може да има и други характерни различия в дозировката на антибиотиците. В България методите за лечение включени в клиничните пътеки се основават на остарели справочници по инфектология, които се нуждаят от редактиране и преосмисляне.
Пълно елиминиране на перзистентните форми и на обвитите с биофилм микроколонии на борелии in vitro е постигнато изключително трудно и то само с едновременна комбинация от няколко синергитиращи си антибиотични препарата [75]. Единственият опит за откриване на насочено средство за конкретна борба с борелиите е чрез инхибиране на осигуряващия оксидазата манган-пренасящ протеин[9]. Понастоящем към антибиотичното лечение се добавят и методи за разпръскване и инхибиране на биофилмите (Biofilm Dispersion and Inhibition) предпазващи бактериалните колонии.
Необходимо е да се обърнете към специалист по инфекциозни болести в най-близкото специализирано лечебно заведение.[76]
Добра история на заболяването
Специфичният подход и дозировка зависят от демографския профил, реалния риск – скорошни пътувания в рисков район, наличие на некомпетентна имунна система и лични обстоятелства, както и анамнезата на пациента. При определяне на лечението също се набляга на засегнатите системи и фазата на развитие на заболяването.
Ухапване без симптоми...
За ухапване от кърлеж без развити след това симптоми не се препоръчва профилактично антибиотично лечение; изключение може да се направи и да се даде изолирана еднократна доза доксициклин от 4 мг/кг или не повече от 200 мг. [77] При решение да се даде профилактична доза, това трябва да стане в рамките на първите 72 часа след отстраняването на кърлежа от кожата. [77] Други автори препоръчват да се пристъпи към пълен курс антибиотик, тъй като еднократната доза би довела само до хронификация на заболяването.
...и със симптоми
От друга страна, за хора с положителни първоначални симптоми, терапията с антибиотици е широко препоръчана, като предпочитаният препарат е доксициклин, за всички пациенти без известна алергия към лекарството както и с изключение на деца под 8-годишна възраст и бременни жени или кърмачки. Този антибиотик е ефективен не само срещу Б. бургдорфери, но и срещу други често разпространявани от кърлежите микроби. [74] Убедително е доказано превъзходството на миноциклин пред доксициклин[78], като освен това той има и позитивна имуномодулаторна функция и предпазва невронните клетки. Алтернативни на доксициклина препарати са амоксицилин, цефтин (цефуроксим аксетил) и азитромицин.[74] Хора, с ранно дисеминирана инфекция с (а) сърдечни симптоми или (б) рефракторен артрит на лаймската болест, както и (в) неврологични симптоми като менингит или енцефалит е желателно да бъдат лекувани с венозни (парентерални) администрации на цефтриаксон [74] (роцефин) за 2 до 4 седмици[77]; при невъзможност за администриране на роцефин, може да се прибегне до комбинацията от цефотаксим заедно с доксциклин.[74] Изследвания in vitro и in vivo[79] доказват, че борелиите могат да оцеляват продължително време под различни форми, които са резистентни на антибиотици – L-форми без стена, цистни[23] форми, както и колонии обвити с биофилм. Най-нови in vitro изследвания установяват, че пълно изчистване на тези форми и особено на обвитите с биофилм микроколонии е възможно само с комбинация от най-малко три антибиотика, като най-ефективно е едновременното приложение на даптомицин, цефоперазон и доксициклин. Разработва се методика на комбинирано лечение [80] – съчетаване на няколко антибиотика с инхибитор на манган-транспортиращия протеин, стимулиране функцията на макрофагите и средства за разпръскване и инхибиране на биофилмите (Biofilm Dispersion and Inhibition) предпазващи бактериалните колонии [81].
Продължителност на лечението
За лицата попадащи в категорията на лечение с орален доксициклин, дозата за възрастни под 40 кг и деца над 8-годишна възраст е 2 мг/кг/доза, орално два пъти на ден; за останалите е 100 мг/доза два пъти на ден.[82] Препоръчителната продължителност на лечението е от една до четири седмици. При упорито отичане на ставите може да се прибегне до втори терапевтичен цикъл. [74] Извън това положение, не се препоръчва лечение по-продължително от 28 дни, тъй като няма клинични доказателства за по-висока ефективност или добри резултати от такива администрации. [74] Години след излагане на антигените на лаймската болест организмът ще поддържа някакви гамаглобулинни нива от типа IgM и IgG, дори и след успешно антибиотично лечение; по тази причина не се препоръчва контрол чрез лаборатория, а по симптоми и общи показатели на остри възпаления.[74]
Не се препоръчват следните антибиотици и лекарствени средства поради липса на ефективност срещу лаймска болест: първо поколение цефалоспорини, флуороквинолони, карбапенеми, ванкомицин, метронидазол, тинидазол, амантадин, кетолиди, изониацид, бактрим, флуконазол, бензатин пеницилин G, комбинирани антимикробиални препарати, пулсово дозиране, дългосрочна антибиотична терапия, лечение срещу бартонела, хипербарична камера, озонови бани, топлотерапия, венозни имуноглобулини, холестирамин, венозен хидроген пероксид (кислородна вода), хранителни суплементни добавки и други.
Съществуват изследвания, които доказват, че дори след антибиотично лечение има шансове за оцеляване на бактерии поради техния плеоморфизъм и възможността им да променят генетичния си код за избягване на лекарствени токсини[54]. При такава промяна на генетичния код бактерията става неоткриваема за съществуващите лабораторни тестове. Същевременно са наблюдавани многократно рецидивиращи заболявания при третираните с антибиотици. [54] Наблюдавани са случаи на резистентност на бактериите, като при някои пациенти, след поредица неуспешни антибиотични курсове клиничните симптоми са били подобрени чрез комбинация от цефоперазон и сулбактам.
Профилактика
Защитно облекло (шапка, дълъг ръкав, светли дрехи, затворени обувки, дълги чорапи и крачоли на панталони затъкнати в тях) и някои антипаразитни препарати като перметрин напръскани върху облеклото са показали добра ефективност поради първичната превенция. Непозволяване на домашните любимци, които обикалят навън да влизат в дома ви, отлична хигиена.
Перметрин напръскан върху облеклото убива кърлежите на място и се продава с тази точно цел. Някои репеленти с препарата Пикардин и етеричното масло от лимонен евкалипт също се твърди, че отблъскват кърлежите.
В райони с висока заболеваемост и популация на първичните гостоприемници – малките бозайници и гризачи, и елени се цели контрол на популациите на първичните гостоприемници и ограничено пръскане с пестициди срещу кърлежи, което накланя баланса в полза на прекъсване на размножителния цикъл на кърлежите.[83]
Необичаен, но явно ефективен подход в някои селски райони е отглеждането на токачки. Птиците са лакоми гастрономи, с особени предпочитания към меню от кърлежи. Този подход намалява употребата на химически пестициди.[84]
Ваксина
В последните години се изследват нови ваксини, които използват външния протеин А или С (OspA или OspC) и гликопротеините като метод за имунизация. В САЩ се провежда ваксиниране на гризачи и тревопасни, чрез поставяне сред природата на обработена с перорална ваксина храна в хранилки. Няколко ваксини са одобрени за имунизация при кучета срещу Лаймска болест.
Външни препратки
- Препоръки на CDC Двустепенно лабораторно изследване за лаймска болест. (на английски: Two-Tiered Testing for Lyme Disease.)
- Клинична оценка, терапия и превенция на лаймска болест, човешка гранулоцитна анаплазмоза и бабезиоза: клинични практически указания от Обществото на американските лекари инфекционисти (на английски: The clinical assessment, treatment, and prevention of Lyme disease, human granulocytic anaplasmosis, and babesiosis: clinical practice guidelines by the Infectious diseases society of America
- Първа помощ при ухапване от кърлеж в онлайн наръчник на FirstAidbg.com
Литература
- Дурмишев А., Илиев Б., Денчев В., Митов Г., Радев М., Ганчева Ц., Баев В., Ангелов Л., Илиева П., Митова Р., Дурмишев Л., Инфектология, АИ „Проф. Марин Дринов“, София 2001, ISBN 954-430-810-5
Източници и бележки
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
