Loading AI tools
من ويكيبيديا، الموسوعة الحرة
قدرة الخلية أو إمكانات الخلية (بالإنجليزية: Cell potency) هي قدرة الخلية على التمايز إلى مختلف أنواع الخلايا التي تكوّن جسم الكائن.[1][2] كلما زاد عدد أنواع الخلايا التي يمكن للخلية أن تتمايز إليها زادت قدرة تمايزها. توصف قدرة الخلية كذلك بأنها احتمالية تنشيط الجينات داخل الخلية، وتنقسم عموما إلى خمسة درجات: تبدأ بالخلية شاملة القدرة ثم كثيرة القدرة ثم متعددة القدرة ثم قليلة القدرة وأخيرا وحيدة القدرة.
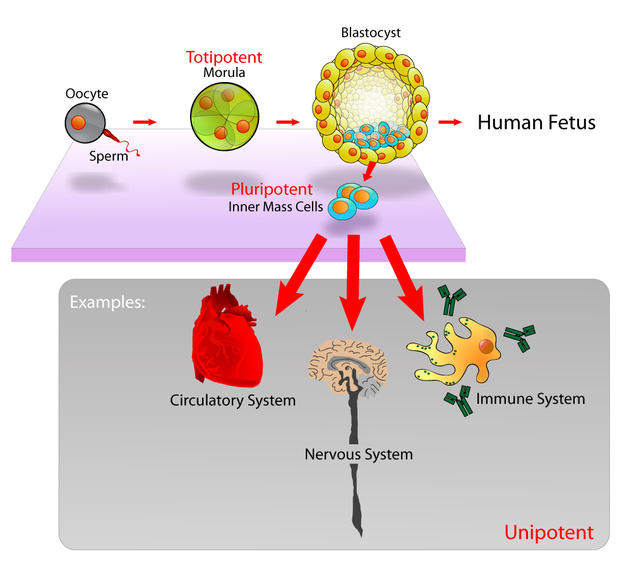
شمولية القدرة (باللاتينية totipotentia، "القدرة على كل شيء") هي قدرة خلية مفردة على الانقسام والتمايز إلى جميع أنواع الخلايا الموجودة في الكائن، الأبواغ والبويضات المخصبة أمثلة على الخلايا شاملة القدرة.[3] في طيف قدرة الخلية، تمثل شمولية القدرة: الخلية التي تملك أكبر إمكانية على التمايز، حيث يمكنها التمايز لأي خلية جنينية وكذلك لأي خلية خارج جنينية [الإنجليزية] وذلك خلافا للخلايا كثيرة القدرة التي يمكنها التمايز إلى الخلايا الجنينية فقط.[4][5]
يمكن لخلية تمايزت بشكل تام أن تعود إلى هيئة شمولية القدرة.[6] التحول إلى شمولية القدرة معقد وغير مفهوم كليا. في 2011، كشفت أبحاث أن الخلايا لا يمكن أن تفقد التمايز [الإنجليزية] إلى خلية شاملة القدرة كليا ولكن إلى "معقد خلوي مختلف" من شمولية القدرة.[7] يمكن للخلايا الجذعية التي تشبه القسيمات الأريمية في مرحلة الأجنة المكونة من خليتين أن تظهر عفويا في مزارع الخلايا الجذعية الجنينية للفأر[8][9] ويمكن كذلك أن تُستحث لتنشأ بتواتر أكبر مخبريا عبر تنظيم بالإنقاص لوظيفة تجميع الكروماتين الخاصة بـCAF-1 [الإنجليزية].[10]
يمكن أن يُستخدم نموذج تكون وتطور الإنسان في وصف كيفية نشوء الخلايا شاملة القدرة.[11] يبدأ تكون وتطور الجنين البشري حين تُخصِّب نطفةٌ بيوضةً وينتج عن ذلك بويضة مخصبة تشكل خلية شاملة القدرة تسمى اللاقحة.[12] في الساعات الأولى بعد التخصيب، تنقسم هذه اللاقحة إلى خلايا متماثلة شاملة القدرة يمكنها لاحقا التمايز إلى أي من الطبقات المنتشة الثلاث الخاصة بالجنين البشري (أديم باطن، أديم متوسط، وأديم ظاهر) أو إلى خلايا المشيمة (أرومة غاذية خلوية أو أرومة غاذية مخلوية). بعد بلوغ مرحلة الـ16 خلية، تتمايز خلايا التوتية شاملة القدرة إلى خلايا تصبح في النهاية إما كتلة الخلايا الداخلية للكيسة الأريمية أو الأرومة المغذية التي تقع خارجها. بعد حوالي أربعة أيام من التخصيب وبعد عدة دورات من الانقسام الخلوي تبدأ هذه الخلايا شاملة القدرة في التخصص وتصبح كتلة الخلايا الداخلية التي هي مصدر الخلايا الجذعية الجنينية كثيرة القدرة.
تقترح أبحاث على الربداء الرشيقة أن آليات متعددة منها: تنظيم الرنا ربما تلعب دورا في الحفاظ على شمولية القدرة في مراحل مختلفة من تطور بعض الأنواع.[13] وتقترح أبحاث على سمكة الزرد والثدييات تآثرا إضافيا بين الرنا الميكروي والبروتينات المرتبطة بالرنا لتحديد مسارات التمايز.[14]
في الخلايا الجنسية الأولية للفأر، إعادة البرمجة [الإنجليزية] على مستوى كل الجينوم المؤدية إلى شمولية القدرة تتضمن محو البصمات فوق الجينية. تحدث إعادة البرمجة بواسطة مثيلة الدنا النشطة التي تتضمن مسار ترميم استئصال القاعدة.[15] تحدث في هذا المسار مثيلة مواقع CpG في الخلايا الجنسية الأولية عبر التحويل الأولي لـ 5-ميثيل سايتوسين (5mC) إلى 5-هيدروكسي ميثيل سايتوسين (5hmC) وهي عملية تقوم بها إنزيمات ديأكسجيناز TET-1 [الإنجليزية] وTET-2 [الإنجليزية].[16]

في علم الأحياء الخلوي، تشير كثرة القدرة (باللاتينية pluripotentia، "القدرة على الكثير من الأشياء")[17] إلى الخلية الجذعية التي تملك قدرة التمايز إلى أيّ من الطبقات المنتشة الثلاث: الأديم الباطن (القناة الهضمية، الرئتين، الكيس المحي)، الأديم المتوسط (العضلات، الهيكل العظمي، الأوعية الدموية، الجهاز البولي التناسلي، الأدمة) أو الأديم الظاهر (الجهاز العصبي والحسي، البشرة)، لكن ليس إلى الأنسجة خارج الجنينية [الإنجليزية] مثل المشيمة.[18] مع ذلك، كثرة القدرة مسترسَلٌ [الإنجليزية] يتراوح من الخلايا كاملة كثرة القدرة التي يمكنها التمايز إلى جميع خلايا الجنين بطريقة سليمة تماما ومن الأمثلة عليها: الخلايا الجذعية الجنينية والخلايا الجذعية كثيرة القدرة المستحثة (iPSCs) إلى الخلايا جزئية أو غير كاملة كثرة القدرة التي يمكن أن تتمايز إلى جميع الطبقات المنتشة الثلاث لكنها يمكن أن لا تعبر عن جميع خصائص الخلايا كاملة كثرة القدرة.
الخلايا الجذعية كثيرة القدرة المستحثة وتختصر iPS أو (إپسك[ملاحظة 1] : iPSC)، هي نوع من الخلايا الجذعية كثيرة القدرة التي تُشتق اصطناعيا من خلايا غير كثيرة القدرة -عادة خلية جسدية بالغة- عبر استحثاث أو إحداث تعبير "قسري" غير طبيعي لبعض الجينات وعوامل النسخ.[19] تلعب عوامل النسخ هذه دورا مفتاحيا في تحديد حالة هذه الخلايا، كما تسلط الضوء على حقيقة أن هذه الخلايا الجسدية تحتفظ بنفس المعلومات الجينية كما هو الحال لدى الخلايا الجنينية الأولية.[20] بُحِثَ في إمكانية استحثاث الخلايا إلى حالة كثرة القدرة أول مرة سنة 2006 باستخدام خلايا الأرومة الليفية الفأرية وأربع عوامل نسخ: Oct-4 [الإنجليزية] وSOX2 [الإنجليزية] وKLF4 [الإنجليزية] وMycc-،[21] ومكنت هذه التقنية التي تسمى إعادة البرمجة [الإنجليزية] لاحقا شينيا ياماناكا وجون غوردون من الحصول على جائزة نوبل في الفيسيولوجيا أو الطب.[22] ثم تلى ذلك في عام 2007 نجاحٌ في استحثاث iPSCs بشرية مشتقة من أرومات ليفية أدمية باستخدام طرق مماثلة لتلك المستخدمة في استحثاث الخلايا الفأرية.[23] تبدي هذه الخلايا المستحثة سمات مماثلة للسمات الخاصة بالخلايا الجذعية الجنينية لكنها لا تتطلب استخدام أجنة. بعض أوجه التشابه بين الخلايا الجذعية الجنينية والـiPSCs هي: كثرة القدرة، التشكل، قدرة التجديد الذاتي وهي سمة تعني أن بإمكانها الانقسام والتضاعف بكمية ولزمن غير محددين، والتعبير الجيني.[24]
يُعتقد أن العوامل فوق الجينية لها دور في إعادة البرمجة الفعلية للخلايا الجسدية في سبيل استحثاث كثرة القدرة. وُضعت فرضيات بأن بعض العوامل فوق الجينية ربما تعمل على إزالة العلامات فوق الجينية الخاصة بالخلية الجسدية في سبيل اكتساب علامات فوق الجينية جديدة تكون جزءا من غاية تحقيق كثرة القدرة. يُعاد ترتيب بنية الكروماتين كذلك في الـiPSCs وتصبح مثل تلك الموجودة في الخلايا الجذعية الجنينية حيث تماثلها في قلة تكدسه وزيادة إمكانية الوصول للجينات للتعبير عنها. التعديلات على الكروماتين المفتوح [الإنجليزية] شائعة كذلك وتتوافق مع حالة الكروماتين المفتوح المتواجد في الـiPSCs أيضا.[24]
نظرا لتشابهها الكبير مع الخلايا الجذعية الجنينية، فإن المجتمعات الطبية والبحثية مهتمة بالخلايا الجذعية كثيرة القدرة المستحثة. يمكن للـiPSCs أن تملك نفس الإمكانيات والتطبيقات العلاجية الخاصة بالخلايا الجذعية الجنينية لكن من دون الخلافات الجدلية حول استخدام الأجنة في عملية الحصول عليها، والذي يُعتبر موضوعا يثير جدلا أخلاقيا كبيرا. أُشيد بكثرة القدرة المستحثة في خلايا جسدية لجعلها iPSCs غير متمايزة واعتُبرت نهايةً لاستخدام الخلايا الجذعية الجنينة المثير للجدل. لكن وُجد أن الـiPSCs يُمكن أن تكون مسببة للأورام ورغم التقدمات،[19] لم يتم اعتماد استخدامها في مرحلة التجارب السريرية في البحوث بالولايات المتحدة سوى مؤخرا. حاليا تُستخدم خلايا سلفية دوبامينية الفعل مشتقة من iPSC ذاتية في التجارب السريرية لمعالجة مرض باركنسون.[25] تمت مواجهة نكساتٍ مثل انخفاض معدلات التضاعف وتشيخ الخلايا المبكر عند صنع الـiPSCs،[26] وهو ما أعاق استخدامها كبديل للخلايا الجذعية الجنينية.
تعبير الخلايا الجسدية عن عوامل نسخ متعددة في آن واحد يمكن أن يستحث بشكل مباشر تغيُّر تمايز الخلية إلى مصائر خلايا جسدية أخرى (تغير نوع الخلية من نوع لآخر وهو ما يعرف بالتمايز التحولي). حدد العلماء ثلاث عوامل نسخ مختصة بالنسب العصبي يمكنها أن تحول مباشرة الأرومات الليفية الفأرية (خلايا النسيج الضام) إلى عصبونات وظيفية كليا.[27] تتحدى هذه النتيجة الطبيعة النهائية الثابتة للتمايز الخلوي ومدى صحة مفهوم الالتزام بالنسب وتوحي إلى أنه بالوسائل المناسبة: جميع الخلايا هي خلايا شاملة القدرة ويمكنها تكوين جميع أنواع الأنسجة.
بعض الاستخدامات الطبية والعلاجية الممكنة للـiPSCs المشتقة من المرضى تشمل استخدمها في زرع الأنسجة والخلايا دون خطر رفضها الذي يواجَه بشكل شائع. يمكن للـiPSCs نظريا أن تكون بديلا للنماذج الحيوانية غير المناسبة وكذلك للنماذج المخبرية التي تُستخدم في الأبحاث حول الأمراض.[28]

أنتجت البحوث المتعلقة بالأديم الخارجي قبل وبعد الانغراس عدة اقتراحات لتصنيف كثرة القدرة إلى حالتين أو طورين متمايزين: "الساذجة" و"المهيئة".[29] الخلايا الجذعية شائعة الاستخدام في البحوث العلمية التي تسمى بالخلايا الجذعية الجنينية يتم تحصيلها قبل انغراس الأديم الخارجي، حيث يمكن لهذا الأديم الخارجي تكوين الجنين بأكمله، وخلية أديم خارجي واحدة قادرة على التفرع إلى جميع السلالات الخلوية إذا تم حقنها في كيسة أريمية أخرى. من جهة أخرى، يمكن ملاحظة عدة علامات فارقة في الأديم الخارجي قبل وبعد الانغراس مثل اختلافهما في الشكل، حيث يغير الأديم الخارجي بعد الانغراس شكله إلى هيئة شبيهة بالكأس تسمى "أسطوانة البيض"، وكذلك في حدوث تغيرات صبغية، حيث يخضع أحد الصبغييين X إلى تعطيل أو تثبيط عشوائي في المرحلة المبكرة من أسطوانة البيض يسمى تعطيل الصبغي X.[30] أثناء هذا النمو، تُستهدف خلايا الأديم الخارجي في مرحلة أسطوانة البيض بشكل نظامي بواسطة عوامل نمو الأرومة الليفية، ومسار تأشير ونت، وعوامل الحث الأخرى عبر الإحاطة بالكيس المحي ونسيج الأرومة المغذية،[31] حيث تصبح متخصصة حسب التعليمات الواردة من البيئة المحيطية.[32]
أحد الفوارق الكبيرة الأخرى هو أن الخلايا الجذعية للأديم الخارجي بعد الانغراس غير قادرة على المساهمة في خيمرة الكيسة الأريمية،[33] وهو ما يميزها عن غيرها من الخلايا الجذعية كثيرة القدرة المعروفة. يشار إلى السلالات الخلوية التي تتفرع من الأديم الخارجي بعد الانغراس بالخلايا الجذعية المشتقة من الأديم الخارجي [الإنجليزية]، والتي استُخلصت لأول مرة في المختبر عام 2007. كل من الخلايا الجذعية الجنينية (ESCs) والخلايا الجذعية المشتقة من الأديم الخارجي (EpiSCs ) مشتقة من أُدُمٍ خارجية لكن في مراحل مختلفة من النمو. كثرة القدرة مازالت سليمة في الأديم الخارجي بعد الانغراس وهو ما يثبته التعبير المحفوظ عن NANOG [الإنجليزية] وFut4 وOct-4 في الخلايا الجذعية المشتقة من الأديم الخارجي،[34] حتى تكون الجسيدات ويمكن عكسها في المنتصف عبر التعبير المستحث عن Oct-4.[35]
لوحظت كثرة قدرة غير مستحثة في مزارع نسيج بارض الجذور (نسيج في قمة الجذر قابل للتكاثر) خاصة بواسطة كريم وزملائه 2015، كيم وزملائه 2018، وروسبوبوف وزملائه 2017. تُنظَّم كثرة القدرة هذه بواسطة عدة عوامل منها: PLETHORA 1 وPLETHORA 2 وPLETHORA 3 وPLETHORA 5 وPLETHORA 7 (وتعرف كذلك بالأسماء PLT1 وPLT2 وPLT3 وPLT5 وPLT7) وجد كريم أن التعبير عنها يحدث بواسطة الأكسين. اعتبارا من 2019، يُتوقع أن تفتح بحوثا مستقبلية حول كثرة القدرة في أنسجة الجذور.[36]

تعدد القدرة Multipotency هو حين تملك الخلايا السلفية إمكانية التنشيط الجيني للتمايز إلى سلالات خلوية مختلفة تماما. على سبيل المثال يمكن للخلايا الجذعية المكونة للدم أن تتمايز إلى عدة أنواع من الخلايا الدموية مثل: الخلايا اللمفاوية والخلايا الوحيدة والخلايا المتعادلة ....، لكن مازال غير واضح ما إذا كانت الخلايا الجذعية المكونة للدم تملك القدرة على التمايز إلى خلايا دماغية أو عظمية أو إلى أنواع أخرى من الخلايا غير الدموية.
تقترح الأبحاث المتعلقة بالخلايا متعددة القدرة أن هذه الأخيرة قد تكون قادرة على التحول إلى أنواع خلوية ليس لها قرابة ببعضها. في حالة أخرى، تم تحويل الخلايا الجذعية الدموية الخاصة بالحبل السري البشري إلى عصبونات بشرية.[37] وتوجد بحوث حول تحويل الخلايا متعددة القدرة إلى خلايا كثيرة القدرة.[38]
توجد الخلايا متعددة القدرة في العديد من أنواع الخلايا البشرية ولكن ليس كلها. وُجدت الخلايا متعددة القدرة في دم الحبل السري،[39] النسيج الدهني،[40] خلايا القلب،[41] نخاع العظم والخلايا الجذعية اللحمية المتوسطية (MSCs) المتواجدة في ضرس العقل.[42]
ثبت أن الخلايا الجذعية اللحمية المتوسطية مصدر قيّم للخلايا الجذعية من الضروس في سن 8-10 من العمر، قبل حدوث تكلس الأسنان لدى البالغين. يمكن أن تتمايز الخلايا الجذعية اللحمية المتوسطية إلى بانيات العظم، خلايا غضروفية وخلايا دهنية.[43]
في علم الأحياء، قلة القدرة هي إمكانية خلية سلفية في التمايز إلى بعض أنواع الخلية، وهي درجة من القدرة. من الأمثلة على الخلايا قليلة القدرة الخلايا النخاعية المشتركة [الإنجليزية] والخلايا اللمفاوية المشتركة.[2] يمكن للخلية اللمفاوية تحديدا أن تتفرع إلى بعض الخلايا الدموية مثل الخلايا البائية والتائية، لكن لا يمكنها التفرع إلى أنواع أخرى مثل الخلايا الدموية الحمراء.[44] من الأمثلة على الخلايا السلفية: الخلايا الجذعية الوعائية التي تملك القدرة على أن تتمايز إلى كل من خلايا البطانة أو خلايا العضلات الملساء.
في علم الأحياء الخلوي، الخلية وحيدة القدرة هي مفهوم يُقصد به أن خلية جذعية واحدة لها القدرة على التفرع إلى نوع خلوي واحد فقط. حاليا غير معروف ما إذا كانت هنالك خلايا جذعية وحيدة القدرة حقيقية. الأرومات الكبدية التي تتمايز إلى خلايا كبدية (والتي يتكون منها معظم الكبد) أو الخلايا الصفراوية الوعائية [الإنجليزية] (الخلايا الظهارية التي تبطن القناة الصفراوية) هي خلايا مزدوجة القدرة.[45] أقرب المرادفات لخلية وحيدة القدرة هو خلية أرومية.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.