ن-بوتيل الليثيوم
مركب كيميائي من ويكيبيديا، الموسوعة الحرة
ن-بوتيل الليثيوم (نظامي بوتيل الليثيوم، ويرمز له اختصاراً n-BuLi) هو مركب ليثيوم عضوي يستخدم كعامل في عدة صناعات. وهو عبارة عن سائل عديم اللون.
| ن-بوتيل الليثيوم | |
|---|---|
| الاسم النظامي (IUPAC) | |
butyllithium, tetra-μ3-butyl-tetralithium | |
| أسماء أخرى | |
نظامي بوتيل الليثيوم | |
| المعرفات | |
| الاختصارات | n-BuLi |
| رقم التسجيل (CAS) | 109-72-8 |
| بب كيم (PubChem) | 61028 |
| |
| الخواص | |
| الصيغة الجزيئية | C4H9Li |
| الكتلة المولية | 64.06 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 0.68 غ/سم3 |
| نقطة الانصهار | -76 °س |
| الذوبانية في الماء | يتفاعل مع الماء (حلمهة) |
| الذوبانية | ينحل في ثنائي إيثيل الإيثر وحلقي الهكسان |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
التحضير
يحضّر مركب ن-بوتيل الليثيوم وذلك بشكل مشابه لتحضير مركبات غرينيار من خلال تفاعل مركب 1-كلورو البوتان مع عنصر الليثيوم في وسط من ثنائي إيثيل الإيثر.[3]
الخصائص
الملخص
السياق
الخصائص الفيزيائية
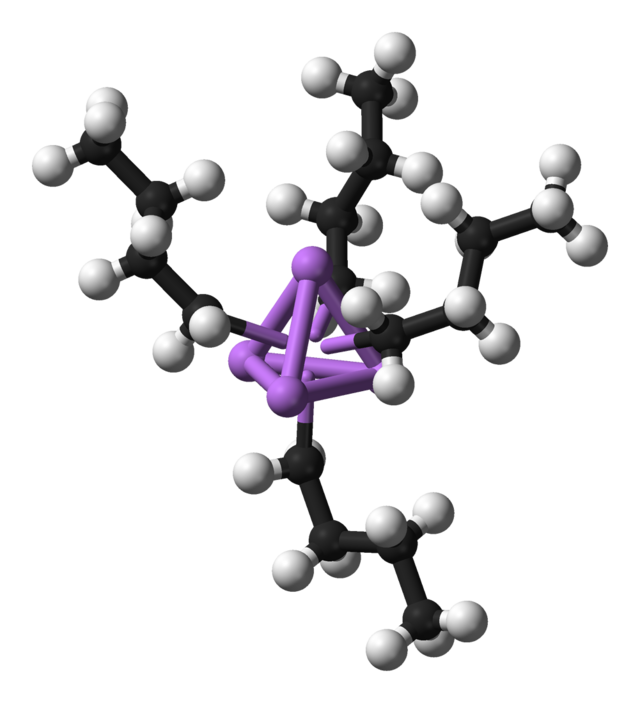
إن مركب ن-بوتيل الليثيوم عبارة عن قاعدة قوية جداً. إن قاعدية مركبات بوتيل الليثيوم المختلفة تزداد بالترتيب التالي: ن-بوتيل الليثيوم ثم ثانوي بوتيل الليثيوم ثم ثالثي بوتيل الليثيوم. بسبب فرق الكهرسلبية الكبير بين عنصري الكربون (2.55) والليثيوم (0.98) فإن الرابطة الكيميائية بين C و Li مستقطبة بشكل كبير.
أظهرت دراسات بمطيافية الكتلة أن مركب ن-بوتيل الليثيوم يكون على شكل سداسي وحدات في الحالة الغازية.[4] تحدث ظاهرة التجمّع في الأوساط السائلة اللاقطبية أيضاً، حيث أن ن-بوتيل الليثيوم يكون على شكل سداسي وحدات في حلقي الهكسان وعلى شكل رباعي وحدات في الإيثر الإيثيلي.
الخصائص الكيميائية
إن مركب ن-بوتيل الليثيوم عبارة عن سائل عديم اللون تلقائي الاشتعال بحيث أنه يشتعل بوجود الأكسجين، على هذا الأساس يحفظ المركب في الهبوات التجارية ضمن جو من غاز خامل.[5]
إن المذيبات المستخدمة مثل رباعي هيدرو الفوران (THF) أو ثنائي إيثيل الإيثر لا تعد مذيبات ملائمة من أجل تخزين ن-بوتيل الليثيوم لأنها تتفكك ببطء بوجوده.[6]
على سبيل المثال فإن n-BuLi في وسط من THF عند 0 °س يتفكك نصفه بعد 38 دقيقة رغم وجود مواد مضافة مانعة للتفكك مثل رباعي ميثيل ثنائي أمين الإيثيلين TMEDA.[7]
يتفاعل ن-بوتيل الليثيوم بشكل ناشر للحرارة مع ثنائي أكسيد الكربون وبشكل عنيف مع الماء. تبلغ حرارة الحلمهة −240 كيلوجول/مول.[8]
التفاعلات
يمكن أن يحدث تفاعل استبدال للهالوجينات في المركبات الكيميائية الكيميائية وذلك مع الليثيوم، مما يعطي طائفة من المركبات التي لها مراكز كربون محبة للنواة، والتي تستخدم من أجل تحضير عدد كبير من المركبات الأخرى. تجرى تفاعلات الاستبدال في وسط من الإيثر عند −78°س كما في التفاعلات التالية (Ar هي أريل أي باقي عطري):
نظراً لقاعديته المرتفعة فإنه بإمكان ن-بوتيل الليثيوم أن يقوم بعملية نزع بروتون من الأحماض الكربوكسيلية ومن الأمينات.
عند تسخين ن-بوتيل الليثيوم n-BuLi يحدث تفاعل حذف من النمط بيتا β، حيث ينشأ بذلك البوتين وهيدريد الليثيوم. يتفاعل n-BuLi مجدداً مع البوتين الناتج بحيث يمكن أن تتشكل نواتج بوليميرية وذلك عبر مركبات البوتاديين. بالتسخين تستهلك نصف الكمية عند 130 °س بعد 315 دقيقة، وعند 140 °س بعد 115.5 دقيقة، وعند 150 °س بعد 49.5 دقيقة.[9]
الاستخدامات
يستخدم ن-بوتيل الليثيوم في الكيمياء العضوية ضمن مجال الاصطناع العضوي لتحضير المركبات وكقاعدة قوية وكعامل لإضافة الليثيوم.
على سبيل المثال يستعمل ن-بوتيل الليثيوم في تحضير ألدهيدات وكيتونات خاصة وذلك من الأميدات ثنائية الاستبدال.
المراجع
Wikiwand - on
Seamless Wikipedia browsing. On steroids.





