إلكترون تكافؤ
من ويكيبيديا، الموسوعة الحرة
ومن أنواع الروابط الكيميائية الروابط الأيونية، والتي تقوم بتوصيل كل من الأيونات الموجبة (الكاتيونات) بالايونات السالبة (الأنيونات)، وينتج من ذلك مركب أيوني. وتصبح الذرة كاتيون بفقد إلكترون أو أكثر، وعند اكتسابها لإلكترون أو أكثر تصبح أنيون.
وصف عام
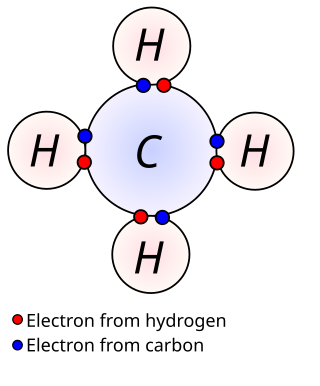
في الكيمياء، تعد إلكترونات التكافؤ هي الإلكترونات الموجودة في الغلاف الخارجي البعيد عن النواة المحيط في الذرة المركزية، هذه الإلكترونات تميل للمساهمة في تكوين رابطة كيميائية (الرابطة الكيميائية تتكون من زوج من الإلكترونات، ولها عدة أنواع: قد تكون تساهمية، أو فلزية، أو أيونية، أو تناسقية، وأنواع عديدة أخرى). في الرابطة التساهمية الواحدة تشترك كلتا الذرتين بإلكترون تكافؤ واحد لتكوين زوج إلكتروني مشترك. إلكترونات التكافؤ هي التي تحدد صفات أو خصائص الكيميائية للعنصر، لهذه العناصر التي تحتوي على عدد إلكترونات تكافؤ متشابهة تكون لها الخصائص نفسها. توجد إلكترونات تكافؤ في الغلاف d غير المشبع بالنسبة لعناصر السلسلة الانتقالية. ذرات العناصر ذات الغلاف الكيميائي المغلق (التي لا تحتوي على الكترونات تكافؤ تكون مستقرة كيميائياً خاملة لا تتفاعل)؛ عناصر الغاز النبيل. ذرات العناصر التي تحتوي على إلكترون تكافؤ واحد أو اثنين تكون ذات فعالية عالية بسبب انخفاض طاقة جذب النواة للإلكترونات بسبب بُعد هذه الأغلفة عن النواة وبالتالي من السهل جدًا إزالتها لتكوين أيونات موجبة، أو اكتسابها إلكترون واحد أو أكثر، وبالتالي تكوين أيونات سالبة.[1] ، أو تساهم بهذه الإلكترونات في تكوين آصرة تساهمية.
ترتيب الإلكترونات
تُملأ الإلكترونات في الأغلفة الإلكترونية من أدنى n إلى أعلى n، حيث n هو عدد الكم الرئيسي (رقم الغلاف)، وإلكترونات التكافؤ تكون في غلاف (n-1). وبالتالي فإن عدد الإلكترونات التكافؤ الذي قد يكون لديها يعتمد على ترتيب الإلكترونات بطريقة بسيطة. مثلًا، الترتيب الإلكتروني للفوسفور (P) هو
1s2 2s2 2p6 3s2 3p3 ، إذ يكون هناك 5 إلكترونات تكافؤية (3s2 3p3)، مطابقة للحد الأقصى لتكافؤ P من 5 كما في الجزيء PF5؛ وعادةً يكتب الترتيب الإلكتروني بطريقة مختصرة
[Ne]10 3S23p3
[Ne]10 تعبر عن عدد إلكترونات العنصر النبيل النيون وتكتب عادةً بوصفها مختصرًا لإلكترونات اللب الأساسية، التي تماثل في شكلها النيون.
ولكن، تملأ العناصر الانتقالية جزئيًا (n−1)d، وتكون أقرب طاقة من مستوى ns، مقارنةً بعناصر المجموعة الرئيسية. تتصرف إلكترونات الغلاف d كإلكترونات تكافؤ على الرغم من عدم وجودها في المستوى الخارجي مثلاً، المنغنيز Mn
1S2 2S2 2p6 3S2 3p6 4S2 4p5
يختصر الترتيب الإلكتروني باستخدام عنصر الكربتون
[Kr]36 4s2 4p5
يمتلك المنغنيز سبع إلكترونات في غلاف التكافؤ، وهذا يتوافق مع الحقيقة التي تقول أن المنغنيز يمتلك حاله تأكسدية +7. يعد غلاف الإلكترونات d أداة بديلة لفهم كيمياء المعادن الانتقالية.
عدد إلكترونات التكافؤ
الملخص
السياق
يمكن تحديد عدد إلكترونات التكافؤ لعناصر الجدول الدوري استنادًا إلى تصنيف عناصر الجدول الدوري إلى زمر (عموديًا) ودورات (أفقيًا).
| إلكترونات التكافؤ | مجموعة الجدول الدوري | أغلفة الجدول الدوري |
| ١
٢ |
الزمرة الأولى: الفلزات القلوية.
الزمرة الثانية: فلزات الأتربة القلوية، والهيليوم. |
S |
| ٣
٤ ٥ ٦ ٧ ٨ |
الزمرة الثالثة: مجموعة البورون.
الزمرة الرابعة: مجموعة الكاربون. الزمرة الخامسة: مجموعة النيروجين. الزمرة السادسة: مجموعة الأوكسجين. الزمرة السابعة: الهالوجينات. الزمرة الثامنة: الغازات النبيلة. |
P |
| ٣-١٢ | مجاميع العناصر الانتقالية
٣-١٢ |
d |
| ٣-١٦ | مجاميع العناصر الانتقالية الداخلية
اللانثانيدات والأكتنيدات |
F |
إلكترونات التكافؤ مسؤولة أيضًا عن التوصيل الكهربي لعنصر ما؛ ونتيجة لذلك، يمكن تصنيف العنصر على أنه معدن، أو لافلز، أو شبه موصل.
تتسم العناصر المعدنية عمومًا بارتفاع معدل التوصيل الكهربائي عندما تكون في الحالة الصلبة. في كل دورة من الجدول الدوري، تظهر المعادن على يسار اللافلزات، وبالتالي فإن المعدن يحتوي على إلكترونات التكافؤ أقل من اللافلز. ولكن إلكترون التكافؤ لذرة معدنية له طاقة تأين قليلة بسبب ابتعاد الغلاف الخارجي عن النواة وبالتالي طاقة جذب النواة للإلكترونات قليلة وبالتالي يحتاج إلى طاقة قليلة لإزالته، وفي الحالة الصلبة يكون إلكترون التكافؤ هذا حرًا نسبيًا ليترك ذرة واحدة لينضم إلى ذرة أخرى قريبة. ويمكن نقل هذا الإلكترون (الحر) تحت تأثير مجال كهربائي، وتشكل حركته تيارًا كهربائيًا؛ وهو مسؤول عن الموصلية الكهربائية للمعادن. النحاس، والألومنيوم، والفضة، والذهب، هي أمثلة الموصلات الجيدة.
العنصر اللافلزي له ناقلية كهربائية منخفضة؛ تعمل بوصفها عازلًا. يوجد هذا العناصر باتجاه يمين الجدول الدوري، وله غلاف تكافؤ نصف مشبع على الأقل (الاستثناء هو بورون). إن طاقة التأين لديها كبيرة؛ والإلكترونات لا تستطيع أن تترك الذرة بسهولة عندما يستخدم المجال كهربائي، وبالتالي فإن هذا العنصر لا يمكن أن يدير إلا تيارات كهربائية صغيرة جدًا. ومن أمثلة العوازل الأساسية الصلبة الماس (وهو عبارة عن خليط من الكاربون) والكبريت.
كما يمكن أن يكون المركب الصلب الذي يحتوي على معادن عازلًا إذا استخدمت إلكترونات التكافؤ للذرات المعدنية لتشكيل روابط أيونية. مثلًا، على الرغم من أن عنصر الصوديوم هو معدن، فإن كلوريد الصوديوم الصلب هو عازل، لأن إلكترون التكافؤ بالصوديوم ينقل إلى الكلور ليشكل رابطة أيونية، وبالتالي لا يمكن نقل الإلكترون بسهولة.
بينما أشباه الفلزات تكون حالة وسطية بين الفلزات واللافلزات.
انظر أيضاً
مراجع
Wikiwand - on
Seamless Wikipedia browsing. On steroids.